- 2025.11.01
- 西山・三浦研究室
アデノ随伴ウイルスベクター(AAV)の課題を克服するスマートナノマシンの開発
遺伝子治療は、疾病の治療を目的として遺伝子または遺伝子を導入した細胞を人の体内に投与する治療法である。この治療では、標的細胞に遺伝子を導入する方法が重要であり、ウイルスが細胞に感染する機構を利用したウイルスベクターが広く利用されている。この中で、アデノ随伴ウイルスベクター(AAV)は、様々な細胞種に遺伝子導入が可能であり、長期的に遺伝子発現が継続することから、脊髄性筋萎縮症、デュシェンヌ型筋ジストロフィー、血友病などの難治性疾患に対して臨床応用されている。しかしながら、成人の大半がAAV中和抗体を自然に持っていること、一度AAVを投与すると中和抗体が産生されてしまうことから、投与可能な患者および複数回の投与が制限されている。また、高用量のAAV投与は肝臓・腎臓への毒性を示し、臨床試験において死亡例も確認されている。 このような課題に対して、ウイルスベクターのカプシドをポリエチレングリコール(PEG)で修飾するアプローチや、リポソームなどの送達担体にAAVを搭載する試みも行われているが、AAVの細胞内取り込みや遺伝子導入効率の低下を招くことが問題となっている。 従って、血液中の中和抗体からAAVを回避し、肝臓への集積を抑えつつ、標的細胞への遺伝子導入を制御できるようなAAV送達システムが強く求められている。
そこで本研究では、ワインや茶に多く含まれるポリフェノールの一種であるタンニン酸(TA)と合成高分子からなるAAV搭載ナノマシンを開発した(Figure 1)。TAは、疎水性相互作用や水素結合を介してタンパク質やAAVなどの生体分子と相互作用し、ナノ複合体を形成する。このTAとAAVから形成されるナノ複合体に側鎖にフェニルボロン酸基を導入したPEG-ポリアミノ酸ブロック共重合体を混合することで表面がPEGで覆われたコア-シェル型のAAV搭載ナノマシンを構築することができる。フェニルボロン酸は、TAのガロイル基とボロン酸エステルを形成し、血中のpH7.4では安定であるが、細胞内のエンドソーム/リソソーム内の酸性環境下(~pH5.5)ではボロン酸エステルが解離し、ポリマーが脱離することでAAVを活性化させることができる。これによって、PEGの修飾等で問題となるAAVの活性低下を回避することが期待される。
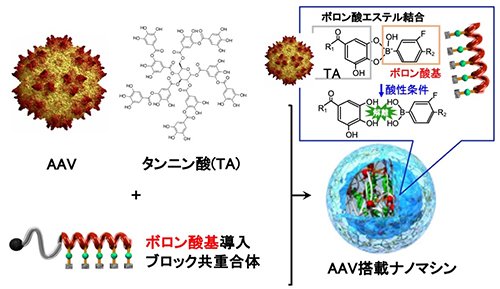 |
|
| Figure 1. | TAとボロン酸基導入ブロック共重合体から形成されるAAV搭載ナノマシンの模式図 |
AAVセロタイプ9型(AAV9) を搭載したナノマシンは59nmのサイズを有していた。HEK293細胞に対するレポーター遺伝子(ルシフェラーゼ, Luc)の発現活性を検討した結果、AAV9の1コピー当たりのLuc発現活性がナノマシンによって増大し、この理由としてAAV9のプロテアソームによる分解がナノマシンによって抑制されることが明らかになった。さらに、抗AAV9抗体(中和抗体)の存在におけるLuc発現活性を評価した結果、AAV9単独およびAAV9/TA複合体では中和抗体存在下でLuc発現活性著しく低下したが、AAV9搭載ナノマシンは高いLuc発現活性を維持することが明らかとなった(Figure 2)。これはナノマシンのポリマーシェルが搭載したAAVを保護することで中和抗体による失活を免れたことによるものと思われる。
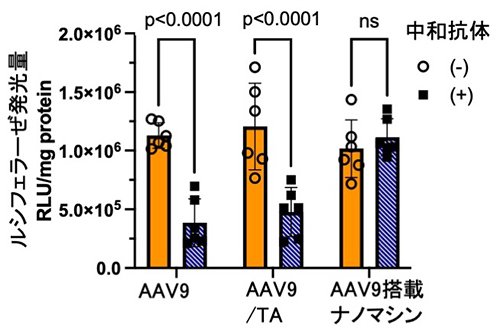 |
|
| Figure 2. | HEK293細胞に対するAAV9のLuc発現活性における抗AAV9抗体(中和抗体)の影響 |
次に、マウスにAAV9に対する中和抗体を含む血清を投与し、その10分後にAAV9を投与することで中和抗体によるin vivo遺伝子導入への影響について評価した。その結果、AAV9単独およびAAV9/TA複合体は血清投与後にLuc発現活性著しい低下を示したが、AAV9搭載ナノマシンは高いLuc発現活性を維持していることが明らかとなった(Figure 3)。さらに、脳および肝臓における遺伝子導入効率はAAV9単独およびAAV9/TA複合体投与群で5-15%に低下した一方、AAV9搭載ナノマシン投与群では約50-60%の遺伝子発現活性を維持しており、AAV9搭載ナノマシンはマウス体内においても中和抗体による失活を抑制できることが明らかとなった(Figure 3)。加えて、安全性に関して、AAV9単独およびAAV9/TA複合体投与群では肝毒性マーカー(GOTおよびGPT)が有意に増加したが、AAV9搭載ナノマシン投与群では肝毒性マーカーは変化せず、肝毒性を抑制できることが明らかになった(Figure 4)。
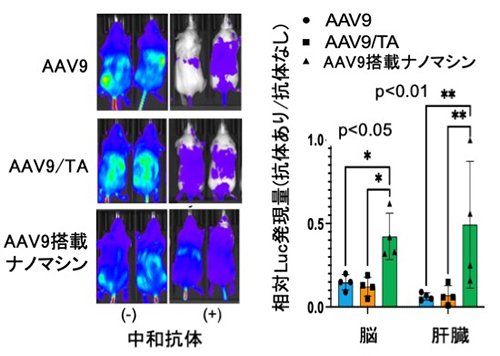 |
|
| Figure 3. | 中和抗体を含む血清を投与したマウスにおけるAAV9の遺伝子発現 |
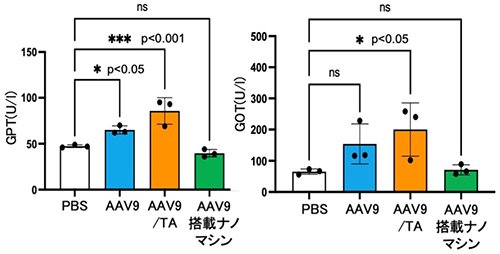 |
|
| Figure 4. | AAV9投与後の血中の肝毒性パラメーター(GOTおよびGPT)の評価 |
最後に、AAV9の脳への遺伝子導入に着目し、AAV9の脳への移行効率を高めることを目的として、マイクロバブルを用いた脳への集束超音波の照射の効果を評価した。本手法は、マイクロバブルの圧壊によって血管内皮の透過性を一過的に亢進させることによって、脳でのAAV9の発現効率の向上が期待できる。AAV9サンプル投与1時間後に1回目、23時間後に2回目の超音波照射を行い、AAV9の遺伝子発現効率を肝臓に対する脳の遺伝子発現効率の比で評価した。その結果、すべてのAAV9サンプルにおいて超音波照射による脳での遺伝子発現の向上が確認されたが、AAV9搭載ナノマシンにおいて2回の超音波照射を行うことで脳に対する遺伝子導入効率が6倍に増加することが確認された(Figure 5)。
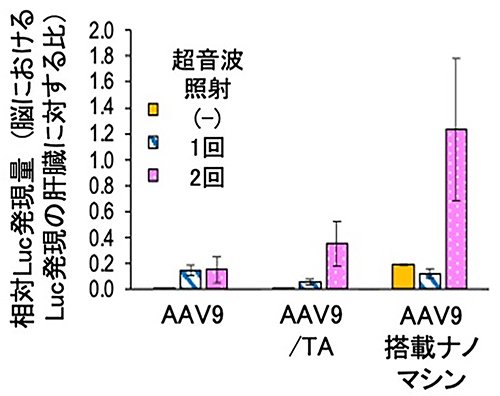 |
|
| Figure 5. | 超音波照射による脳に対するAAV9の選択的遺伝子発現(肝臓に対するLuc発現効率) |
以上のように、本研究では、AAVの臨床における課題である中和抗体による失活や肝臓等の正常組織における副作用を回避することに成功した。本技術は、遺伝子治療の有効性や安全性を向上させ、対象となる疾患の拡大や患者数の増加にも貢献することが期待される。また、脳への遺伝子発現の選択性の向上によって、アルツハイマー病等の神経変性疾患への適用も視野に入ってくるだろう。近年、CRISPRによるゲノム編集治療など遺伝子治療の高度化が進み、ウイルスベクターの機能向上に対する期待がとみに高まっている中で、我々は本技術が先端医療に貢献することに大いに期待しており、さらなる機能高度化を進めていきたいと考えている。
参考文献
Honda, S. Nagao, H. Kinoh, X. Liu, N. Matsudaira, A. Dirisala, S. Nitta-Matsutomo, T. Nomoto, H. Hayashita-Kinoh, Y. Miura, T. Okada, N. Nishiyama, Adeno-associated virus self-assembled with tannic acid and phenylboronic acid-polymers to evade neutralizing antibodies and reduces adverse events. ACS Nano 19(8)7690-7706 (2025) (doi: 10.1021/acsnano.4c11085)
Science Tokyoニュース「ワイン成分を搭載したナノマシンを用いて 遺伝子治療の課題を世界で初めて克服」2025年2月26日(https://www.isct.ac.jp/ja/news/qslw3w2dgz1k)



