最新の研究
- 2015.06.05
赤外超解像顕微鏡法による毛髪α-ケラチンの分子配向イメージング
1.はじめに
「赤外顕微鏡で細胞内部を観察する」といえば聞こえも良く簡単にできそうですが、市販の赤外顕微鏡で実現することは実は不可能なんです。これは、赤外光の波長(2.5〜25 µm)とレンズの開口数によって一意に決まる光の回折限界のために、赤外顕微鏡では高い空間分解能で試料を観察することが物理的に不可能で、せいぜい10 µm程度の分解能しか得られないことに起因します。例えば、毛髪のスライス片(横断面)を光学顕微鏡で透過像を観察すると毛髪内部に濃淡が見られることから局所部位でいろいろな構造をとっていることがわかります(図1(a))。これを市販の赤外顕微鏡でタンパク質のアミド結合のNH伸縮振動でイメージングを行った結果が図1(b)です。アミド結合が毛髪内部に存在していることははっきりとわかりますが、赤外顕微鏡の空間分解能が10 µm程度と低いために、透過像で濃淡として観察された毛髪内部の構造がぼやけてしまい、アミド結合が毛髪のどの部分にどれだけ存在しているか全くわからなくなっています。これは、生体試料の場合、組織レベルでの観察は可能ですが、細胞レベルでの観察はできないことを意味しており、非常に小さなものを観察するためのツールである「顕微鏡」としては致命的な欠点といえます。
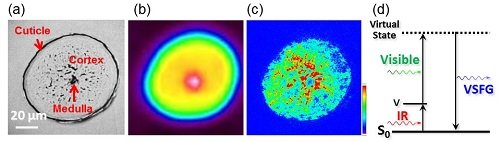
図1
(a) 毛髪横断面の光学顕微鏡による透過像.
(b) 市販の赤外顕微鏡による赤外透過像(3330 cm−1).
(c) 赤外超解像顕微鏡像.ピコ秒の可視光(610 nm)と赤外光(3330 cm-1)を同時に入射して観測.(a)-(c)のスケールバーは20 µm.
(d) 振動和周波発生法.
2.赤外超解像の原理
このような背景の中、私たちは、2波長レーザー分光法を顕微鏡技術と融合することで、光の回折限界を突破した極めて高い空間分解能(即ち、超解像)を有する赤外顕微鏡の開発に取り組んできました[1, 2]。皆さんご存知のように2014年ノーベル化学賞は「超解像顕微鏡」に贈られましたが、これは従来の光学顕微鏡の限界(光の回折限界)を超えて非常に小さなものが見える超高解像度蛍光顕微鏡の開発業績が評価されたものです。私たちの取り組みは、これとコンセプトは同じにして、赤外波長領域において光の回折限界を超える超高解像度、即ち「赤外超解像」を実現しようというものです。開発の鍵となる赤外超解像は、1)赤外可視2波長レーザー分光法を適用することで赤外吸収を可視発光に変換し、2)発生する可視発光のみを集光・結像する、独自のアイディアで達成可能と考えました。今回は、上述の1)に赤外可視2波長レーザー分光法の1つである振動和周波発生(VSFG)法を利用した手法をご紹介します。分子に赤外光と可視光を同時に入射すると、実際には存在しないエネルギー準位(仮想準位)に遷移した後、2つの振動数の和に相当するVSFG光が発生します(図1(d))。このVSFG 光の強度は赤外光の波長が分子の振動に一致したときに著しく増大するので、試料からのVSFG 光を観察することで分子の赤外吸収の情報を得ることができます。VSFG法は、赤外吸収を可視波長領域の発光として観測するため、空間分解能は赤外光の回折限界より遥かに小さな可視発光の回折限界まで容易に向上することができ、赤外超解像が達成されます。
実際に、同じ毛髪スライスにたいしてVSFG法を利用した赤外超解像顕微鏡観察を行った結果を図1(c)に示していますが、一見してわかる程、空間分解能が飛躍的に向上しており、毛髪内部のアミド結合の分布をはっきりと見ることができます。結論から言うと、これは毛髪の主成分であるα-ヘリックス構造を有するケラチンタンパク質(α-ケラチン)[3, 4]の分布を観察した赤外像に相当します。空間分解能はおよそ840 nmであり、赤外波長から見積もられる回折限界4.6 µmを遥かに凌駕した赤外超解像を実現しています。
3.分子配向イメージング
VSFG法を利用した赤外超解像顕微鏡のもう1つの特徴は、光の偏光の組み合わせを考慮することで、分子配向に関する詳細な情報が得られることです。VSFG検出赤外超解像顕微鏡を用いて、毛髪α-ケラチン(試料:毛髪横断面)のアミドバンドに対して赤外超解像イメージングを行った結果を図2に示します。
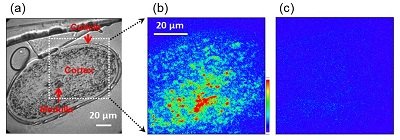 図2
図2
(a) 毛髪横断面の透過像.
(b) アミドIIIバンドによる赤外超解像.(可視:610 nm,
赤外:1250 cm-1).
(c) アミドIバンドによる赤外超解像.(可視:610 nm,
赤外:1650 cm-1).
アミドIIIバンド(1250 cm-1)においては高感度でα-ケラチンの分布が観測される(図2(b))一方、アミドIバンド(1650 cm-1)においてはα-ケラチンが全く観測されない(図2(c))現象を見出しました。分子論的に考察すると、アミドIバンドは主にC=O伸縮振動モードに対応し、アミドIIIバンドはC-N伸縮振動モードに対応する(図3(a))ので、α-ケラチンでは両者の振動モードはほぼ直交な関係になります(図3(b))。毛髪横断面を使った実験ではアミドIIIバンドのみ観測可能であったことから、アミドIIIが横断面方向=α-ケラチンが毛髪伸長方向にきれいに配向しており、α-ケラチンの分子配向がVSFGの信号強度に影響を及ぼしたと結論しました[5]。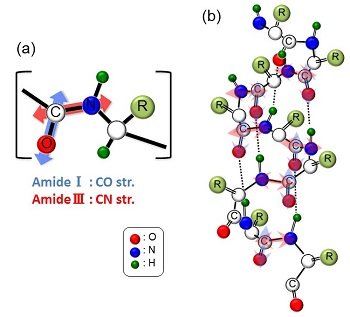
図3
(a) アミドIとIIIの振動モード.
(b) α-ケラチン中におけるアミドIとIIIの振動
これを検証する実験として、毛髪伸長方向に垂直にカットした横断面だけではなく、斜め断面(図4(a):断面の角度α = 45°)についてアミドIバンドによる赤外超解像イメージングを行った結果、横断面では観測されなかったVSFG像を斜め断面では明瞭に観測できることがわかりました(図4(b)、(c))。この結果は、α-ケラチンの分子配向を変えることで、アミドIバンドのVSFG像を観測できたことを示しており、α-ケラチンの分子配向イメージングに成功したことを実証しています。

図4
(a) 斜め断面の切断角度 α.
(b) アミドIにおける毛髪横断面(α = 0º)の赤外超解像.
(c) アミドIにおける毛髪斜め断面(α = 45º)の赤外超解像.
4.まとめ
私たちは、VSFG法を利用した赤外超解像顕微鏡を開発し、市販の赤外顕微鏡では観察不可能であった、毛髪の内部構造を明瞭に赤外超解像観察することに成功しました。得られた赤外超解像は、毛髪内部のα-ケラチンのみを高感度に抽出した像であり、かつ、分子配向も観察できることがわかりました。これは、VSFG検出赤外超解像顕微鏡法が、生体試料中の不均一系から規則性を抽出することに極めて有効であることを示す結果であり、生体試料観察へ新たな可能性を拓いたものと考えています。
References
[1] K. Inoue, M. Fujii, M. Sakai, Appl. Spectrosc. 64 (2010) 275.
[2] M. Sakai, K. Inoue, M. Fujii, Curr. Pharm. Biotechno. 14 (2013) 159.
[3] P. Dumas, L. Miller, Vib. Spectrosc. 32 (2003) 3.
[4] K.L.A. Chan, S.G. Kazarian, A. Mavraki, D.R. Williams, Appl. Spectrosc. 59 (2005) 149.
[5] M. Sakai, K. Kikuchi, M. Fujii, Chem. Phys. 419, (2013) 261.



