最新の研究
- 2017.10.02
- 北口研究室
蛍光タンパク質センサーを自由自在につくる
私たちの身体の中ではどんなことが起こっているのだろうか?
生物が成長し維持されるメカニズムや病気の原因を明らかにするためには、生きた細胞や生物個体の中のタンパク質、脂質、イオン、代謝産物などの分子が、どのように分布、移動し、相互作用しているかを明らかにする必要がある。我々は生きた細胞内の狙った分子の挙動を、抗体を基盤としたバイオセンサーを開発することで可視化する方法を構築したので紹介したい文献1。
一般に生体内の多くの分子は色を持たないため、そのままの状態でこれを高い時空間分解能で検出・解析するのは容易ではない。これまで生体内分子を蛍光標識するさまざまなバイオセンサーが開発され、蛍光顕微鏡によりその動態が可視化されてきた。特に蛍光タンパク質を利用したバイオセンサーは、生きた細胞内で簡単に発現させることができ、組織・細胞特異的発現や細胞内小器官への局在も可能なことから、中心的に用いられているバイオセンサーと言える。この蛍光タンパク質センサーは、分子認識ドメインに既知の結合タンパク質を利用することで構築され、さまざまな成果を挙げてきた。しかし、注目する分子の結合タンパク質が未知であったり、そもそも存在しない場合はセンサーを作ることができないという問題があった。そこで多様な抗原に対して認識する能力を持つ抗体を、センサーの分子認識ドメインとして用いて、任意の分子に対して自由自在にセンサーを開発できないかと考えた(図1)。
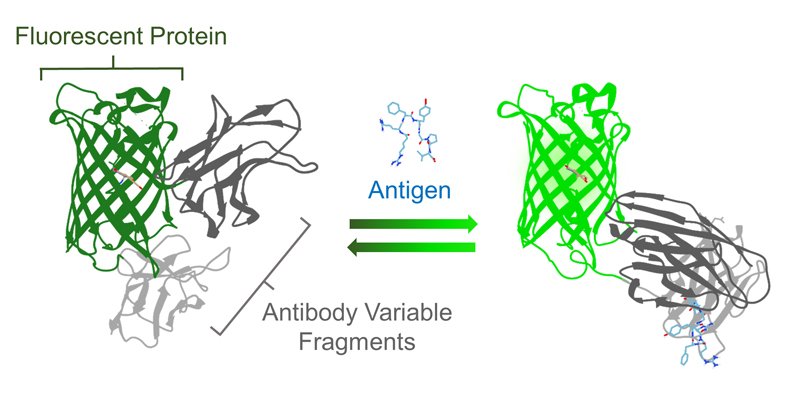 図1文献1
図1文献1
抗体と蛍光タンパク質を融合したセンサーFlashbodyの模式図.
(©American Chemical Society)
分子を認識するタンパク質としては、骨代謝マーカー・オステオカルシンのC末ペプチド(BGPC7; RRFYGPV)を認識する抗体、光で情報を発信するタンパク質としては、蛍光タンパク質GFPの円順列変異体cpGFPを用いることにした(図2)。cpGFPの発色団近傍に作ったN末とC末のそれぞれに抗体の可変領域の重鎖(VH)と軽鎖(VL)を融合し、抗原が結合して発色団近傍の環境の変化を引き起こすことで、蛍光輝度変化を生じさせる。この戦略で抗体を分子認識ドメインとした蛍光タンパク質センサーを作製し、抗原(BGPC7)を添加したところ、わずかに輝度変化を起こすプロトタイプセンサーを構築できた。そこで、輝度変化率を増大させるため、抗体と蛍光タンパク質をつなぐアミノ酸リンカーの長さや種類をスクリーニングし、最終的に抗原添加により4倍の輝度変化を起こすセンサーの開発に成功した。このセンサーは当研究室で開発した化学修飾型の抗体センサーQuenchbody文献2にちなんでFlashbodyと名付けている。
 図2
図2
Flashbodyの分子デザインと最適化したリンカー部分.
Flashbodyは遺伝子コード型であるため大腸菌で発現させ、タンパク質として精製することができる。Flashbodyタンパク質の蛍光スペクトルを測定したところ、cpGFPとほぼ同じ513nmにピークがある緑色蛍光を示した(図3)。また蛍光輝度は抗原の濃度に依存して増加し、異なるペプチド(Mycタグ)では蛍光輝度変化を起こさない抗原特異性のあるセンサーであった。次に、Flashbodyの細胞内における機能を検討した(図4)。FlashbodyをHeLa細胞の細胞質(局在シグナルなし)と核(核局在シグナル付加)への発現を試みたところ、それぞれの場所に局在させることができた。そして、flock house virus (FHV)由来の膜透過性ペプチド(CPP)を融合した抗原ペプチド(FHV-BGPC7)を細胞外へ添加し、抗原への応答を検討したところ、細胞質、核どちらにおいてもFlashbodyの蛍光輝度が上昇し、抗原ペプチドが細胞内や核へ導入されていることを可視化できた。また、細胞膜での蛍光輝度は1点から数点のポイントで上昇し、核での上昇は全体的に徐々に上昇していた。これは膜透過性ペプチドの細胞膜と核膜での透過の機構が異なることを示している。
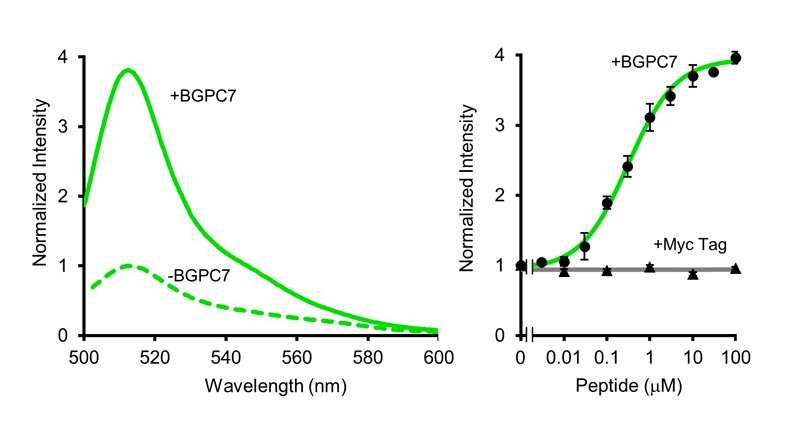 図3文献1
図3文献1
Flashbodyの蛍光スペクトル(左)と濃度依存曲線(右).
(©American Chemical Society)
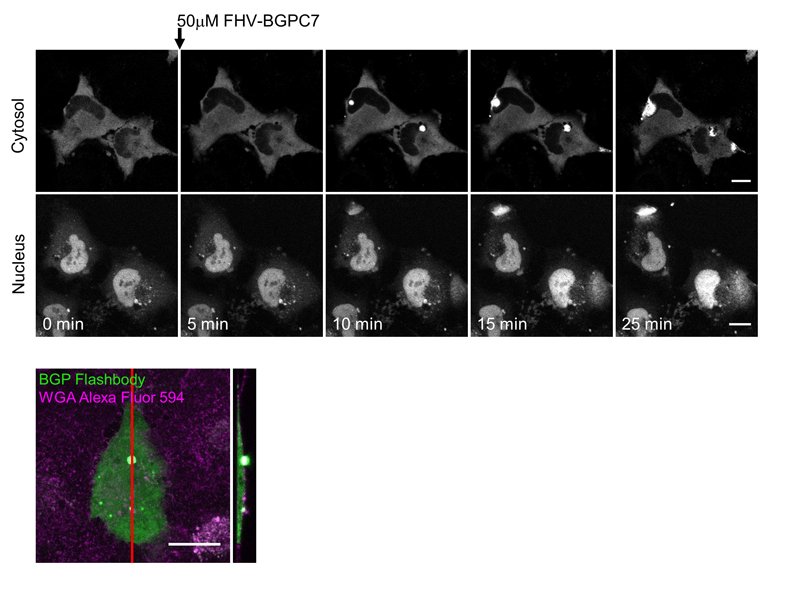 図4文献1
図4文献1
膜透過性抗原ペプチド(FHV-BGPC7)がHeLa細胞の細胞質および核へ透過する様子(上)とペプチドが透過途中の細胞のXY、YZ断面像(下).(©American Chemical Society)
Flashbodyの開発により、蛍光タンパク質センサーの分子認識の多様性が飛躍的に向上すると考えられる。抗体のアミノ酸配列はある程度保存されており、同様の手法により多くの抗体をセンサー化できると期待される。また遺伝子コード型であることから、細胞内での検出はもちろんのこと、細胞内小器官における高詳細な検出、トランスジェニック動物の個体における組織や細胞特異的な検出にも使用できよう。さらに蛍光タンパク質センサーを精製すれば、臨床検査、環境調査、食品検査などへの応用も可能である。今後は、異なる抗体や異なる蛍光色の蛍光タンパク質でFlashbodyを作製し、複数分子のマルチカラーによる同時検出を目指したい。
参考文献
[1] D. Wongso, J. Dong, H. Ueda, T. Kitaguchi, Anal. Chem., 2017, 89, 6719-6725.
[2] R. Abe, H. Ohashi, I. Iijima, M. Ihara, H. Takagi, T. Hohsaka, H. Ueda. J. Am. Chem. Soc., 2011, 133, 17386-17394.



