最新の研究
- 2018.06.01
- 西山・三浦研究室
エチレンジアミン構造に基づく高分子ベタインの電荷制御とナノ粒子の腫瘍送達への展開
生体内環境において、マテリアルと生体内物質との相互作用を決定づけるのは、マテリアルの表面物性に他なりません。とりわけ、制がん剤や造影剤を内包可能なナノ粒子は、がん治療や診断への応用に向けて広く研究が進められていますが、体内に投与されたナノ粒子が腫瘍に到達する過程で生体内で異物として認識されない必要があります1。そこで、ナノ粒子の表面はしばしばポリエチレングリコール(PEG)等の高分子にて修飾することで、血液中の物質と相互作用せず、免疫応答も回避する(ステルス性)ように設計されてきました2。そしてそのような高分子の1つに、高分子ベタインが挙げられます3。
ベタインはカチオン性基とアニオン性基とが共在した構造であり、高分子ベタインはその電荷が中性の際に強力な水和能を発揮することで、その他の物質との相互作用を低減します。そのため、生体内応用を目指した高分子ベタインは、生体内環境に相当する中性pH7.4においては電荷が釣り合うように設計するのが定石でした。ここで、我々が注目したのは、がん組織内のpHが弱酸性であるということです。がん組織においては、その特異的な代謝の結果、酸性の代謝物が多く分泌されており、組織内のpHは〜6.5程度まで低下しています4。通常の生体内環境においては電荷が釣り合うことで物質との相互作用の低減が望まれますが、がん組織内においてはむしろ組織を構成する物質と相互作用するように設計した方がナノ粒子のがん組織への集積を効率化出来るのではないか、と考えました。
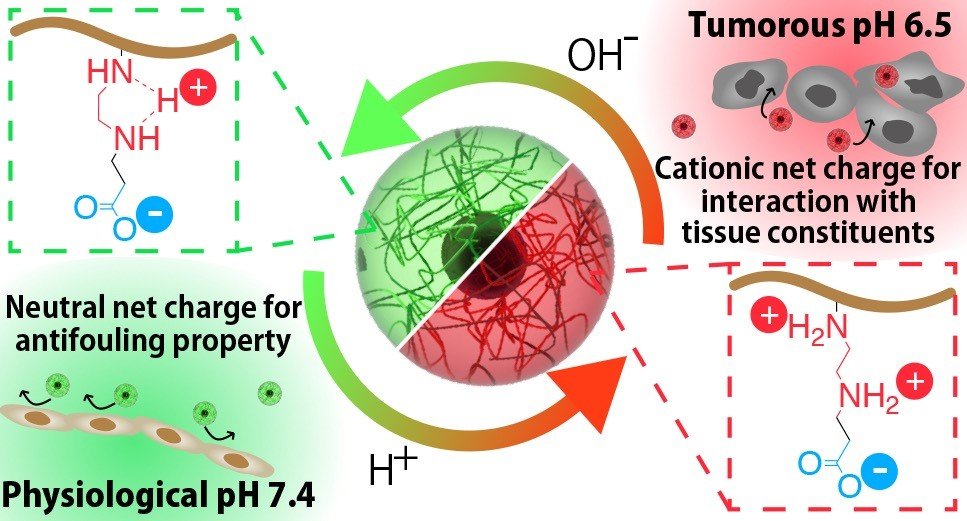
腫瘍内弱酸性pHに応答する機能性高分子ベタインを開発するにあたって、エチレンジアミン構造に着目しました。エチレンジアミン構造は、生体内中性条件では1のカチオン性電荷を有しますが、弱酸性pHにおいてはカチオン性電荷が2へと増大します5。この特性を有する高分子ベタインを設計することで、正常組織や血液中ではステルス性を発揮するが、がん組織においては集積を促すようなナノ粒子を構築出来ると考えました(図1)。6
(図1 本研究で開発される構造体のイメージ図)
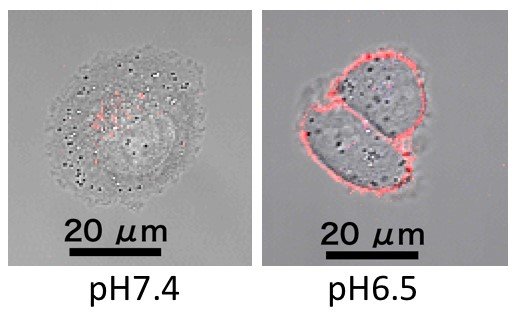
実際に、エチレンジアミンを有する高分子ベタイン(PGlu(DET-Car))を合成し、そのpH応答挙動を確認するために細胞との相互作用を観察しました(図2)。すると、pH7.4では細胞と相互作用しないのに対し、pH6.5では細胞膜にPGlu(DET-Car)が張り付いている様子が確認されました。これは、PGlu(DET-Car)は弱酸性pHに応答して電荷バランスが崩れ、細胞と相互作用するようになったことを示しています。
(図2 PGlu(DET-Car)と培養細胞とのpH依存的な相互作用)
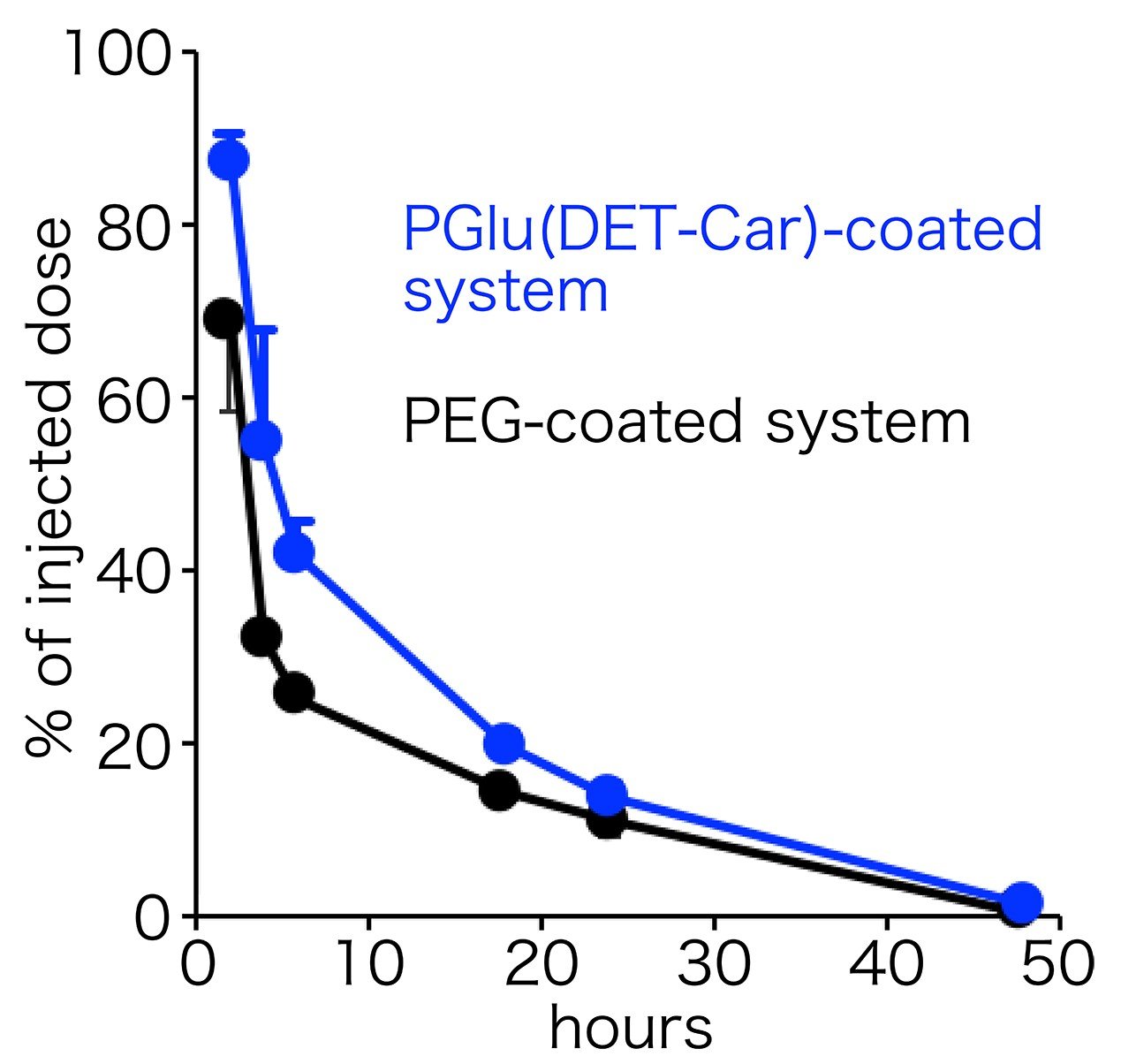
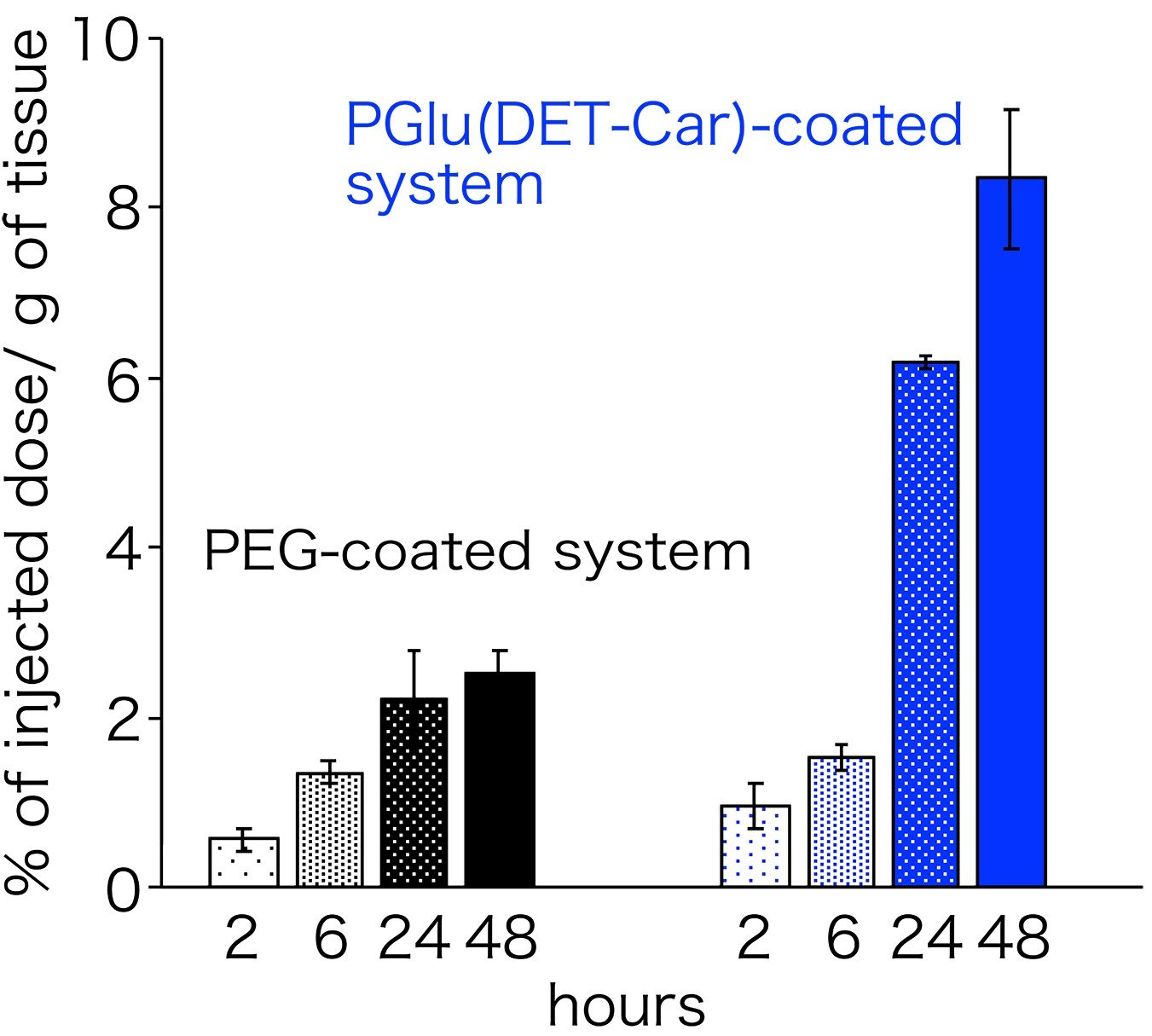
次に、PGlu(DET-Car)をナノ粒子に被覆し、それをマウスの担がんモデルに静脈投与しました。すると、PEGで被覆した系と同等の血中滞留性及び正常臓器への分布を示しました。このことから、血液中および正常組織に対しては、PGlu(DET-Car)はPEGに匹敵するステルス性を発揮することがわかります(図3)。このことは、カチオン性高分子にて被覆した系と比べて高い血中滞留性と肺組織への集積低減(肺は血液中で凝集した粒子が集積しやすい)からも明らかです。特筆すべきことに、がん組織に関しては、PEGの系に比較して約3倍の集積量を示しました(図4)。血液中及び正常組織に対しては同等の挙動を示したことを考慮すると、がん組織への集積量増大はPGlu(DET-Car)ががん組織内pHに応答して性質を変化させたことを裏付けます。中性条件においてはステルス性を発揮するが、がん組織内においてはがん細胞や組織内物質と相互作用することでナノ粒子ががん組織内の滞留性が向上したからだと考えられます。
(図3 被覆ナノ粒子の血中滞留性評価)
(図4 被覆ナノ粒子の腫瘍集積性評価)
このように、高分子ベタインにおいて、そのイオン性基のpH応答性を考慮することでがん組織へのナノ粒子の送達量を増大可能であることを本研究では見出しました。今回紹介した系において、現在はイオン性基のさらなる検討や実際の薬物を搭載した際の挙動の評価を検討しています。
参考文献
[1] G. Morgese, B. Shirmardi Shaghasemi, V. Causin, M. Zenobi-Wong, S. N. Ramakrishna, E. Reimhult, E. M. Benetti, Angew. Chem. Int. Ed. 2017, 56, 4507-4511.
[2] A. L. Klibanov, K. Maruyama, V. P. Torchilin, L. Huang, FEBS Lett. 1990, 268, 235-237.
[3] A. K. Nowinski, F. Sun, A. D. White, A. J. Keefe, S. Jiang, J. Am. Chem. Soc. 2012, 134, 6000-6005.
[4] R. K. Jain, T. Stylianopoulos, Nat. Rev. Clin. Oncol. 2010, 7, 653-664.
[5] K. Miyata, M. Oba, M. Nakanishi, S. Fukushima, Y. Yamasaki, H. Koyama, N. Nishiyama, K. Kataoka, J. Am. Chem. Soc. 2008, 130, 16287-16294.
[6] A. H. Ranneh, H. Takemoto, S. Sakuma, A. Awaad, T. Nomoto, Y. Mo-chida, M. Matsui, K. Tomoda, M. Naito, N. Nishiyama, Angew. Chem. Int. Ed. 2018, 57, 5057-5061.