最新の研究
- 2019.03.01
- 北口研究室
極小サイズのペプチドタグで,蛋白質間相互作用を光で検出
ヒトの1細胞内においては、数十万ペアもの蛋白質間相互作用が起きていると言われます。蛋白質間相互作用は、生命現象における大半の役割を担っていますので、生命現象を理解し、新しい薬や診断方法を開発するためには、蛋白質間相互作用の理解が必要です。細胞内で蛋白質間相互作用を検出する方法としては、蛍光蛋白質、または発光酵素をプローブとして相互作用蛋白質に融合させる方法が一般的ですが、そのプローブのサイズが大きすぎると発現時にミスフォールディングや立体障害が問題となる場合があります。そこで、私達は、今回、蛋白質間相互作用検出のための極小サイズのプローブを構築することに成功しました1)。
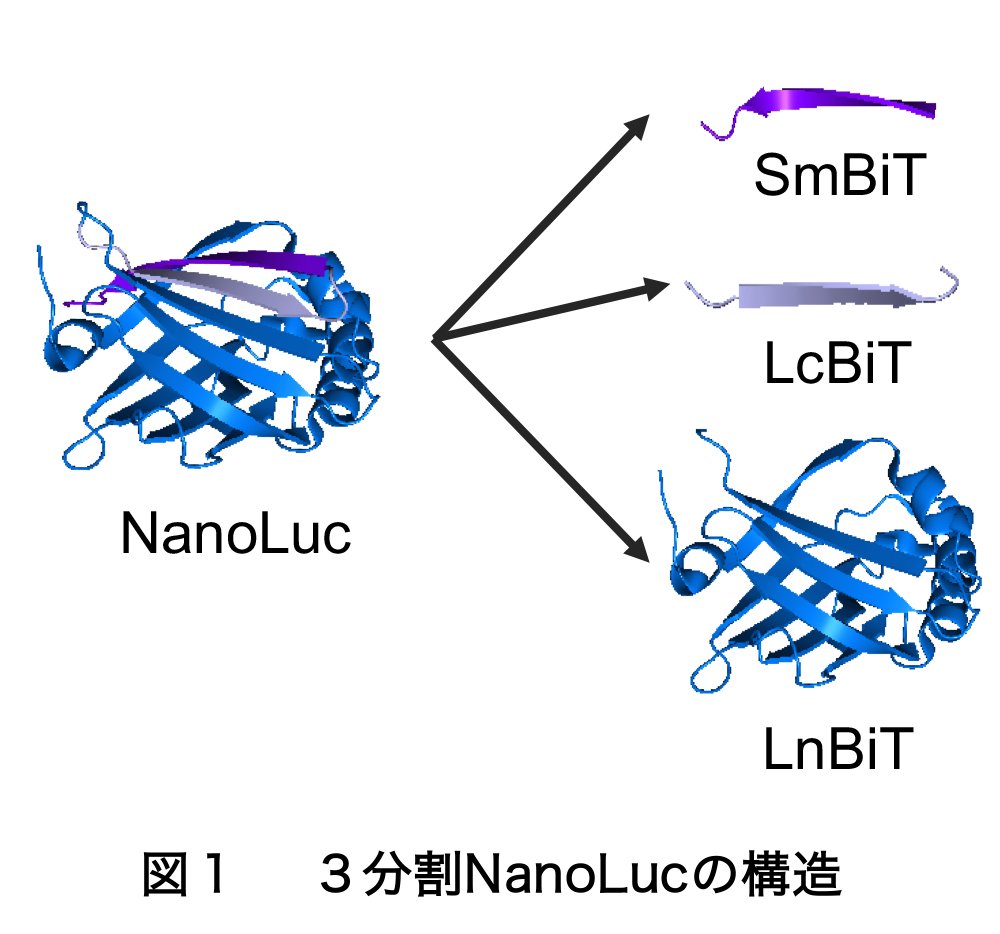
そのために私達は、最近開発された深海エビ由来の比較的小さな(~19 kD)発光酵素NanoLucを利用しました。NanoLucは非常に明るいだけでなく、構造がとても安定です。NanoLucはその大部分が11個のβ-ストランドから構成されます。通常行われるタンパク質相互作用検出系Protein-fragment Complementation Assay (PCA)では、信号検出のための酵素、または蛍光タンパク質を2分割します。既存のNanoLuc PCAでは、NanoLucを、C末β-ストランド1個からなる「SmBiT」と残り部分の「LgBiT」に分けています2)。それに対し、私達は、NanoLucをβ-ストランド各1個からなる2プローブ、「LcBiT(LgBiTのC末β-ストランド)」・「SmBiT」と残りのN末側「LnBiT」の3つに分けました(図1)。LcBiT・SmBiTは各11アミノ酸という小さなプローブです。
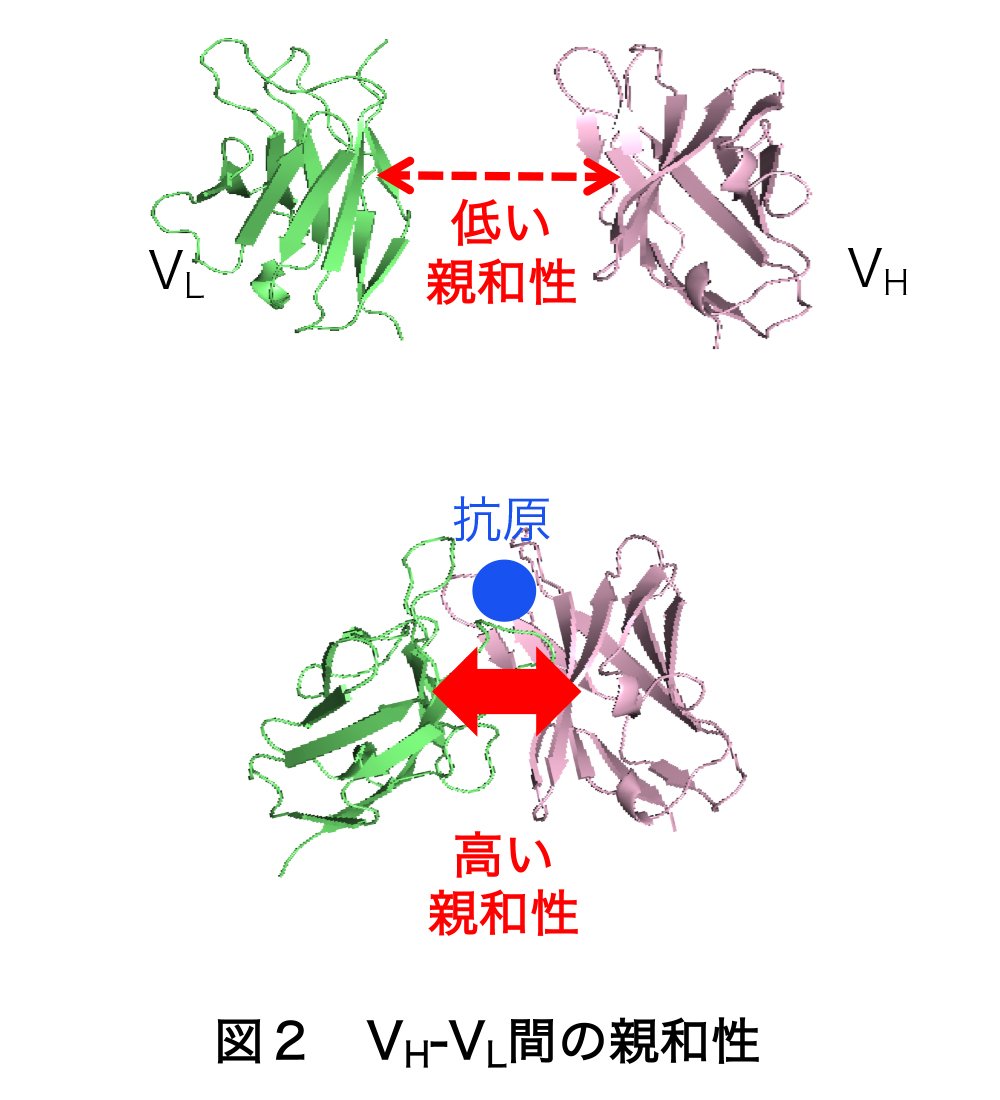
私達の研究では、相互作用する蛋白質ペアとして、抗体の抗原結合部位を構成する二つの断片VH・VLを使用しました。特に低分子を認識する抗体では、抗体から切り離したVHとVLの間の親和性が抗原がないときには低い事が多く、ここに抗原を加えるとVH-VL間の親和性が著しく高まります(図2)。ただVH・VLを別のタンパク質と融合させるとフォールディングに問題が起きることもあり、従来のNanoLuc PCAを用いた場合では、機能的なプローブを得られませんでした。そこで今回、小さなプローブLcBiT・SmBiTを利用して、VHとVLの抗原依存的な結合について、測定を試みました。
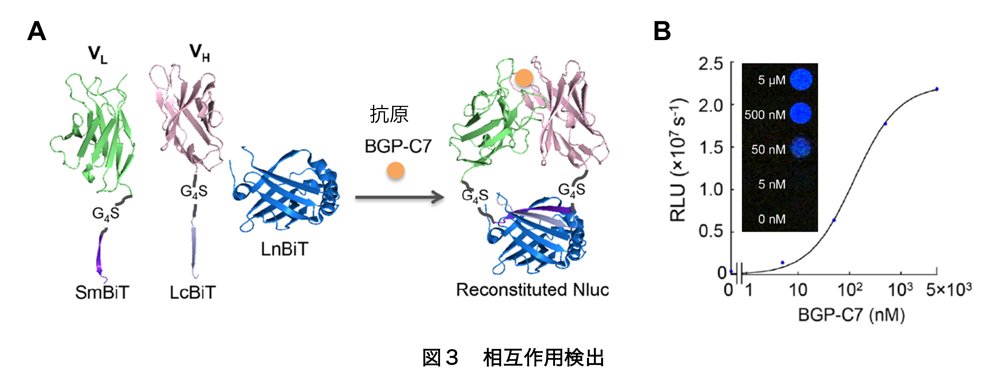
VH・VLにLcBiT・SmBiTをそれぞれ付加したタンパク質を調製し、LnBiTとともに抗原(オステオカルシンペプチド, BGP-C7)を加えた結果、発光値が大きく上昇しました(図3A)。さらにSmBiTのアミノ酸配列を最適化しました。SmBiT改変配列とLgBiTの親和性を調べた報告2)を参考にし、KD値がSmBiTの1.9×10-4 Mに対し、2.5×10-6 M・1.8×10-7 M・0.7×10-9 MのSmBiT改変配列の利用を試みました。その結果、最も親和性が高い配列を利用して、シグナル/バックグラウンド比を維持したまま、肉眼で観察できる程度までシグナルが上昇しました(図3B)。
本法「NanoLuc3分子テクノロジー」は、そのプローブの小ささから、今まで解析できなかった複雑な構造の蛋白質について解析する手段となりえます。私達は今、すべての蛋白質間相互作用検出を可能にする万能プローブの構築を目指し、このNanoluc3分子テクノロジーの改良を行なっています。
参考文献
- 1) Y Ohmuro-Matsuyama & H Ueda, Homogeneous noncompetitive luminescent immunodetection of small molecules by ternary protein fragment complementation. Anal. Chem. 90, 3001-3004 (2018)
- 2) AS Dixon et al. NanoLuc complementation reporter optimized for accurate measurement of protein interactions in cells. ACS Chem. Biol., 11, 400-408 (2016)