最新の研究
- 2019.11.05
- 西山・三浦研究室
精密設計機能性高分子を基盤とした薬物送達システムの光線力学療法への展開
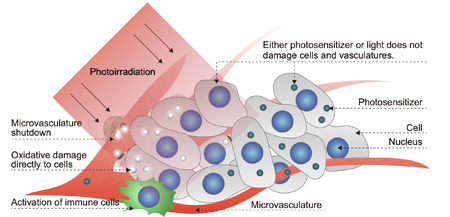
近年、低侵襲的にがんを治療する方法として光線力学療法(PDT)が注目されています。PDTは、光増感剤(光に応答して細胞傷害性の高い活性酸素を産生する薬物)をがんに集積させた後、がんの存在する部位に光を照射することにより、がんを選択的に殺傷します(図1)(1)。より詳細なメカニズムとしては、がん細胞に対する活性酸素によるダメージという直接的な効果の他に、がん関連血管に傷害を与えて血流を阻害しがんに栄養が届かないようにして殺傷する間接的な効果があります。さらに、PDTを行うと免疫細胞が活性化されることが報告されており、近年注目されている免疫療法との併用療法が期待されています。現在、フォトフリンやレザフィリン等の光増感剤が既に臨床で使用されており、早期肺がん等に対して極めて優れた治療実績が得られています。一方で、これらの光増感剤が選択的に集積できないがんもあり、PDTの適用範囲を広げていくためには、光増感剤を効率的にがん組織に送り届けるための新しい技術が必要です。そのような光増感剤をがんに送り届ける技術として、我々は精密設計高分子を基盤とした薬物送達システムの開発に取り組んできました。ここでは、下記2つの我々の開発した高分子コンジュゲート型薬物送達システムについて紹介します。
- 1.腫瘍内低pHに応答して等温相転移挙動を示す高分子コンジュゲート型薬物送達システム
- 2.腫瘍関連血管と腫瘍細胞の両方を標的とする高分子コンジュゲート型薬物送達システム
- 1. 腫瘍内低pHに応答して等温相転移挙動を示す高分子コンジュゲート型薬物送達システム
一般的に腫瘍のpHは正常組織と比較して低くなっており、pH6.8~7.3程度の値を示すことが知られています。我々は、pH7.4の血中や正常組織などでは親水性を示して細胞や生体物質と相互作用せず、一方で低pH環境では疎水的となり積極的に細胞と相互作用するような高分子を構築できれば腫瘍選択的に薬物を送達できるのではないかと考えました。しかし、今までに低pH応答性薬物送達システムは多くの研究者により開発されてきましたが、pH6.8~7.3という非常に微量なpH変化に応答する薬物送達システムはほとんど報告されていませんでした。そこで我々は、下限臨界溶液温度(LCST*)を示す温度応答性高分子であるpoly(N-isopropylacrylamide) (PNIPAAm)をベースとして、一定温度(37°C)において微量なpH低下に応答して親水性から疎水性に物性を変化させる機能性高分子(P(NIPAAm/AIPAAm-PMM))を開発しました(図2)(2)。本高分子は生理的pH (7.4)では親水性を示し細胞に取り込まれにくい性質を示しましたが、pHが低下すると極めて効率的に細胞に取り込まれました(図3)。マウス皮下腫瘍モデルを用いた実験では、がん組織に選択的に集積することが示されました。現在、光増感剤を搭載してその治療効果を検討していますが、極めて強力な抗腫瘍活性が得られています。
*LCST: LCSTを示す高分子は、LCST以上の温度では疎水性を示し、LCST以下の温度では親水性を示します。
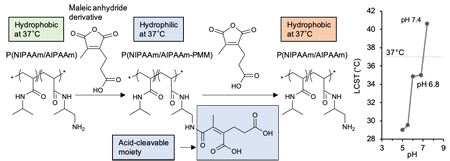 図2. pHの微量低下に応答して親水性から疎水性に物性を変化させる機能性高分子 (P[NIPAAm/AIPAAm-PMM]) (2).
図2. pHの微量低下に応答して親水性から疎水性に物性を変化させる機能性高分子 (P[NIPAAm/AIPAAm-PMM]) (2).
 図3. 腫瘍内pHに応答して疎水性になり、細胞に取り込まれる様子を描いた表紙 (2).
図3. 腫瘍内pHに応答して疎水性になり、細胞に取り込まれる様子を描いた表紙 (2).
- 2. 腫瘍関連血管と腫瘍細胞の両方を標的とする高分子コンジュゲート型薬物送達システム
腫瘍選択性をさらに高めるには、積極的に腫瘍と相互作用する分子を設計することが重要です。また、PDTの原理を有効活用するには、腫瘍細胞だけでなく腫瘍関連血管も同時に標的とすることが有用であると我々は考えました。そこで我々は、腫瘍関連血管と多くの腫瘍細胞で過剰発現が報告されているαvβ3インテグリンを標的とした高分子コンジュゲートを開発しました(図4)(3)。具体的にこの高分子コンジュゲートは、poly(ethylene glycol)-poly(L-glutamic acid)という生体適合性高分子の側鎖に、αvβ3インテグリンに対して強いアフィニティを持つ環状RGDペプチドが複数導入され、末端に親水性の光増感剤IRDye 700DXが結合した構造を持ちます。本高分子コンジュゲートはαvβ3インテグリン過剰発現細胞に選択的に効率よく取り込まれました。また、マウス皮下腫瘍モデルに対して静脈注射を行うと、正常組織にはほとんど集積せず、極めて腫瘍選択的に集積しました。そして、高分子に結合する環状RGDペプチドの数を増やすほど、腫瘍に長期的に滞留し、腫瘍血管に対して集積しやすくなるという性質が見られ、さらにはPDT効果が飛躍的に上昇しました。この研究から、腫瘍細胞と腫瘍関連血管の両方を標的とすることはPDTにおいて有用であることが示唆されました。
以上のように、我々は精密設計高分子を基盤としながら、多角的なアプローチで腫瘍選択的に光増感剤を送達する技術を開発しています。実際のヒトのがんは、個体差が大きく様々な表現型を有しているため、このように多様な治療法を確立して、それぞれの患者さんに適した方法を選択していくことが重要であると考えています。
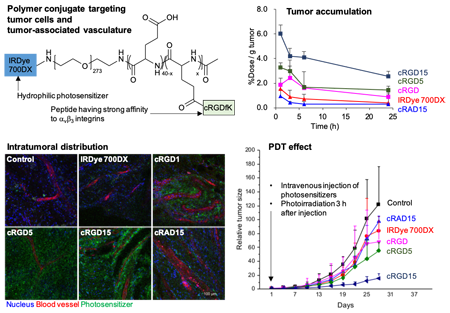 図4. 腫瘍関連血管と腫瘍細胞の両方を標的とした高分子コンジュゲート (3).
図4. 腫瘍関連血管と腫瘍細胞の両方を標的とした高分子コンジュゲート (3).
参考文献
1. T. Nomoto, N. Nishiyama, Design of drug delivery systems for physical energy-induced chemical surgery. Biomaterials 178, 583-596 (2018).
2. S. E. Muttaqien, T. Nomoto, H. Takemoto, M. Matsui, K. Tomoda, N. Nishiyama, Poly( N-isopropylacrylamide)-Based Polymer-Inducing Isothermal Hydrophilic-to-Hydrophobic Phase Transition via Detachment of Hydrophilic Acid-Labile Moiety. Biomacromolecules 20, 1493-1504 (2019).
3. X. Dou, T. Nomoto, H. Takemoto, M. Matsui, K. Tomoda, N. Nishiyama, Effect of multiple cyclic RGD peptides on tumor accumulation and intratumoral distribution of IRDye 700DX-conjugated polymers. Sci. Rep. 8, 8126 (2018).