最新の研究
- 2019.12.01
- (旧)藤井研究室
- (旧)藤井研究室
- (旧)藤井研究室
- (旧)藤井研究室
- (旧)藤井研究室
- (旧)藤井研究室
- (旧)藤井研究室
- (旧)藤井研究室
- (旧)藤井研究室
- (旧)藤井研究室
冷却イオントラップ法によるK+チャネルのイオン選択性へのボトムアップアプローチ
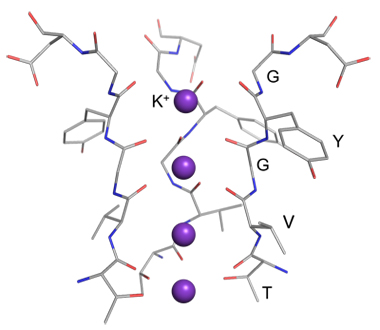
K+チャネルはK+のみを透過させる膜タンパク質であり、生体内で重要な役割を果たします。K+チャネルのイオン選択性は非常に高く、K+よりも多量に存在している Na+をほとんど透過しません。K+のイオン半径は1.5 Åであるのに対して、Na+は1.2 Åであり、イオン半径の小さいNa+がなぜK+チャネル中を透過できないのかという疑問が浮かびます。そのため、K+チャネルの選択的なイオン透過のメカニズムは非常に興味深く、これまで多くの研究がなされてきました。MacKinnonグループはあるK+チャネルの結晶化に成功し、選択フィルターと呼ばれるアミノ酸配列GYGVT(G: グリシン、Y: チロシン、V: バリン、T: スレオニン)が K+に配位することを見出しました(図1)[1]。この配位構造はK+の水和構造に近く、K+の脱水和によるエネルギー損失を選択フィルターとの結合により十分補償できるものと考えられています。しかし、Na+が水和と競合して選択フィルターから取り除かれる過程は実験的に観測されておらず、理論計算[2]からの予測にとどまっています。そこで本研究では、K+チャネル選択フィルターの部分ペプチドGYGとアルカリ金属イオン(Na+, K+)の錯体を溶媒の存在しない気相中に取り出し、エレクトロスプレー・冷却イオントラップ分光法により構造を明らかにしました[3]
エレクトロスプレー法によりGYG-M+(M = Na+, K+)を気相中に生成し、四重極質量分析計で夾雑イオンを取り除き、4 Kまで冷却したイオントラップで捕捉します[4]。ここに水素ガスを導入し、トラップしたGYG-M+に付着させます。イオンが赤外光を吸収すると、水素が解離した解離物イオンが生成するため、この解離物のイオン量をモニターしながら赤外レーザーを波長掃引することで赤外吸収スペクトルを測定できます。
図2にGYG-Na+とGYG-K+の気相中での赤外吸収スペクトルを示します。両錯体のスペクトルには3400~3500 cm−1付近に強いバンドが観測され、これらはペプチドのNH伸縮振動に帰属されます。さらに、先端的な分光手法を用いることでこれらのバンドを異性体ごとに帰属することができます(図2)。量子化学計算と組み合わせることで、2つのC=Oが金属イオンに配位した構造(O/O, O/O')と、C=Oに加えベンゼン環も配位した構造(O/O/R)が異性体として観測されていることを明らかにしました(図2)。GYG-Na+とGYG-K+では、異性体の構造モチーフ自体は同じですが、異性体の存在比は大きく異なっていることがわかります。すなわち、GYG-K+ではO/O (O/O') 型構造がメインであるのに対して、GYG-Na+ではO/O/R型構造の割合が著しく増大しています。O/O型構造は選択フィルター中でのペプチドの構造と類似していますが、O/O/R型構造は選択フィルター中では実現できない構造です。つまり、GYG-Na+でO/O/R型構造の寄与が大きいことは、選択フィルターGYGに対してNa+の(O/O型の)配位が不安定であることを示唆しています。
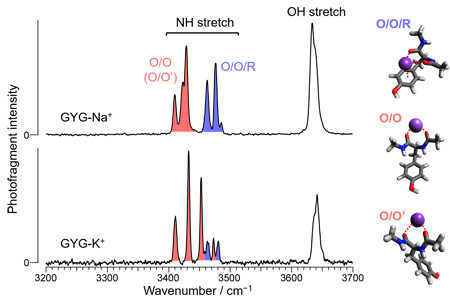 図2.GYG-M+ (M = Na+, K+)の赤外吸収スペクトルと構造帰属.
図2.GYG-M+ (M = Na+, K+)の赤外吸収スペクトルと構造帰属.
【参考文献】
- 1. Zhou, Y.; Morals-Cabral, J. H.; Kaufman, A.; MacKinnon, R. Nature 2001, 414, 43.
- 2. Varma, S.; Sabo, D.; Rempe, S. B. J. Mol. Biol. 2008, 376, 13.
- 3. Ishiuchi, S.; Sasaki, Y.; Lisy, J. M.; Fujii, M. Phys. Chem. Chem. Phys. 2019, 21, 561.
- 4. Ishiuchi, S.; Wako, H.; Kato, D.; Fujii, M. J. Mol. Spectrosc. 2017, 332, 45.