最新の研究
- 2020.05.07
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
レドックス制御システムの違いがシアノバクテリアの光合成と窒素固定の両立を可能にする
【背景】
細胞内の生理活性は、様々なシステムにより調節されている。そのシステムの一つがレドックス制御である。レドックス制御システムは、酵素タンパク質の酸化還元状態を変化させることにより、その活性を調節する。光合成生物では、チオレドキシン(Trx)が光合成で得られた還元力を標的タンパク質に伝達することで、光環境の変化に応答した代謝制御が行なわれている。Trxはジチオール-ジスルフィド交換反応により標的を還元し、標的の活性を調節する。
葉緑体の起源と言われるシアノバクテリアは、光合成研究において極めて重要な微生物である。Anabaena sp. PCC 7120(Anabaena 7120)は、細胞が数珠状に連なった糸状性のシアノバクテリアで、窒素源が欠乏すると数珠上に連なった栄養細胞が、10~20個に1個の割合でヘテロシストという特殊な細胞へ分化するという特徴を持っている。ヘテロシストでは、細胞内に取り込んだ大気窒素を、光合成で得られたエネルギーや酸化的ペントースリン酸経路で獲得した還元力を利用してアンモニアに還元する。このアンモニアを用いて生成されたアミノ酸は、隣接する栄養細胞へ供給される。Anabaena 7120ではレドックス制御システムが、光条件だけではなく窒素条件の変化にも応答していることを、私たちは既に明らかにしている1)。
【目的】
グルコース6-リン酸デヒドロゲナーゼ(G6PDH)は、酸化的ペントースリン酸経路ではたらく酵素であり、ヘテロシストでは窒素固定に必要な還元力を供給するのに重要な役割を担っている。私たちは、以前、シアノバクテリアでは光照射下でTrxがG6PDHの活性化因子であるOpcAを還元することにより、G6PDHの活性を間接的に抑制することを明らかにした1)。また、Anabaena 7120では、窒素条件によって細胞内のOpcAのレドックス状態が変化し、窒素欠乏条件下では光照射下であっても大部分のOpcAが酸化されG6PDHが活性を維持していることも明らかにした1)。これらの結果から、窒素固定を行なうヘテロシストでは、光照射下でもOpcAが酸化型で存在しているものと予想された。なぜ光照射下であっても、ヘテロシスト内ではOpcAが酸化されているのだろうか。この疑問をきっかけに、本研究では、ヘテロシスト内のレドックス制御システムを解明することを目指した。
【結果】
これまでの研究で、窒素欠乏条件下では栄養細胞とヘテロシストでTrxの標的のレドックス状態が異なる可能性が示された。そこで、Trxの標的として知られているCP12に緑色蛍光タンパク質(GFP)を融合し、栄養細胞とヘテロシストにそれぞれ特異的に発現させた。CP12は、細胞内のTrxの標的のレドックス状態を可視化するセンサーとして利用されている2)。この融合タンパク質を栄養細胞に発現させた株をV-CP12株、ヘテロシストに発現させた株をH-CP12株とした(図1A)。続いて、これらの株からレドックス状態を固定したままタンパク質を抽出後、GFP抗体を用いたイムノブロッティングを行ない、それぞれの細胞におけるCP12のレドックス状態を調べた。タンパク質のレドックス状態は、チオール基修飾剤AMSを用いて決定した。V-CP12株では窒素源の有無に関わらず、暗条件下でCP12が酸化され、光照射により還元された3)(図1B)。一方、窒素欠乏条件下のH-CP12株では、光照射下と暗条件下でCP12のレドックス状態に大きな違いが見られず、光照射下であっても50%程度が酸化状態になっていた3)(図1B)。これらの結果は、ヘテロシストにおいて、Trxの標的が光による制御を受けていないことを示している。
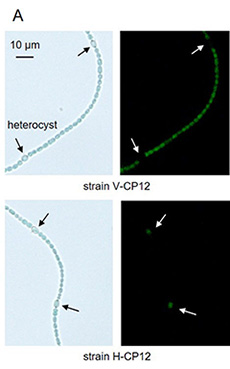
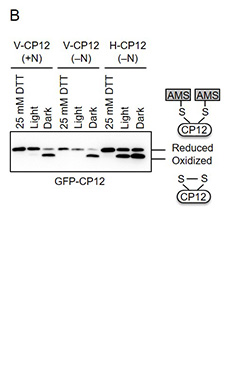
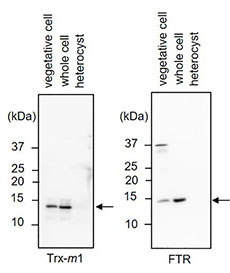
図1 窒素添加条件(+N)または窒素欠乏条件下(-N)の栄養細胞とヘテロシストにおけるTrxの標的のレドックス状態
栄養細胞とヘテロシストそれぞれからタンパク質を抽出し、各種抗体を用いたイムノブロッティングを行ない、レドックス制御システムを構成するTrx還元酵素やTrxの発現様式を調べた。OpcAの効率の良い還元力ドナーであるTrx-m1およびTrx還元酵素であるFTRは、栄養細胞では検出されたが、ヘテロシストでは検出されなかった3)(図2)。これらの結果は、ヘテロシストではTrx還元酵素やTrxの発現量が著しく低下していることを示している。
図2 栄養細胞、全細胞、ヘテロシストにおけるFTRおよびTrxの発現
【まとめ】
本研究では、ヘテロシストにおいて光に依存したレドックス制御が行なわれていないことを明らかにした。ヘテロシストでは還元力ドナーである光化学系IIが欠損していること、Trx還元酵素やTrxの発現量が減少するため、標的が一部酸化型で存在していると考えられる(図3)。このような栄養細胞とヘテロシストのレドックス制御システムの違いにより、光照射下であってもヘテロシスト内でG6PDH 活性を維持することが可能となり、窒素固定に必要な還元力が生産されることになる。このため、Anabaena 7120 は光照射下で光合成と窒素固定を両立することができるものと考えられる。
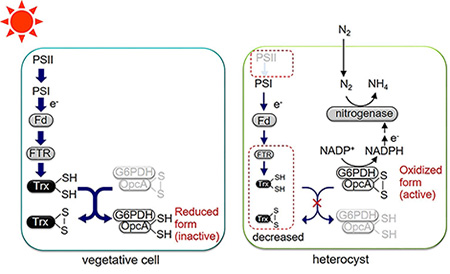 図3 本研究で明らかになった栄養細胞とヘテロシストのレドックス制御システム
図3 本研究で明らかになった栄養細胞とヘテロシストのレドックス制御システム
以上の研究成果は、Journal of Experimental Botanyに発表した。
【参考文献】
1.Mihara, S., Wakao, H., Yoshida, K., Higo, A., Sugiura, K., Tsuchiya, A., ... Hisabori, T. (2018). Thioredoxin regulates G6PDH activity by changing redox states of OpcA in the nitrogen-fixing cyanobacterium Anabaena sp. PCC 7120. Biochemical Journal. https://doi.org/10.1042/BCJ20170869
2.Sugiura, K., Yokochi, Y., Fu, N., Fukaya, Y., Yoshida, K., Mihara, S., & Hisabori, T. (2019). The thioredoxin (Trx) redox-state sensor protein can visualize Trx activities in the light-dark response in chloroplasts. Journal of Biological Chemistry, jbc.RA119.007616. https://doi.org/10.1074/jbc.ra119.007616
3.Mihara, S., Sugiura, K., Yoshida, K., & Hisabori, T. (2020). Thioredoxin targets are regulated in heterocysts of cyanobacterium Anabaena sp. PCC 7120 in a light-independent manner. Journal of Experimental Botany, 71(6), 2018-2027. https://doi.org/10.1093/jxb/erz561