最新の研究
- 2021.11.01
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
光合成生物特有のATP合成酵素制御メカニズムを解明
【背景】
ATP合成酵素は、いわゆるエネルギー産生膜と呼ばれる生体膜に存在し、一般に電子伝達系の働きによりこの膜の内外に形成されるプロトンの電気化学ポテンシャル差(プロトン駆動力)を利用して、ADPと無機リン酸からATPを生産する酵素です。このとき、プロトンは勾配を解消する方向に移動します。ところが、十分なプロトン駆動力が形成されていない時には、ATPの加水分解によって生じたエネルギーを使ってプロトンを逆方向に輸送することも知られています。私たちは光合成生物のチラコイド膜に存在するATP合成酵素(FoF1)に着目して、この酵素の制御機構の研究をつづけてきました。
 |
|||
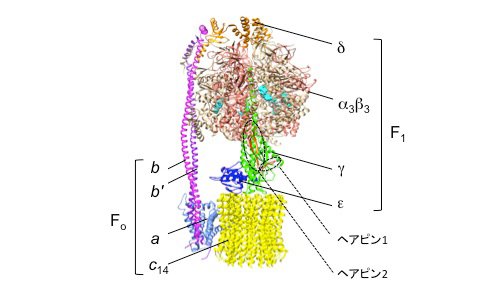
| 図1. | ホウレンソウ葉緑体のF型ATP合成酵素の構造(PDB ID: 6FKF)。表在性膜タンパク質のF1部分と内在性膜タンパク質のFo部分に分けられる。チラコイド膜に局在するATP合成酵素において、中心回転子を形成するγサブユニット(薄緑)には特有の挿入部分があり、二つのヘアピン構造を形成している(赤;ヘアピン1、オレンジ;ヘアピン2)。α3β3に結合したMgADP/ATPを水色であらわした。 | ||
図1は、ホウレンソウ由来FoF1の構造です[1]。FoF1は分子量が50万を超える巨大なタンパク質複合体で、20個以上のサブユニットで構成されています。この酵素は、膜表在性でATPの合成と加水分解の触媒部位を持っているF1部分と膜内在性でプロトンの通り道であるFo部分に分けられ、F1部分のサブユニット構成はα3β3γδε、Fo部分はabb′c14です。F1部分のα3β3の6量体で構成されるヘッド部分の中央を貫くγサブユニットは、εサブユニットとともに中心回転子として機能しており、ATPの加水分解反応時にはα3β3部分で起こる構造変化を、γ,εとc リングが構成する中央回転軸の回転に変換する役割を担っています。
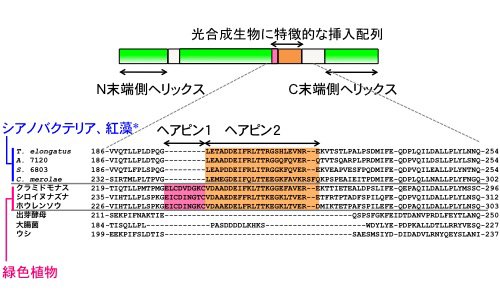
興味深いことに、光合成生物のγサブユニットには、他の生物種には見られない特徴的なアミノ酸配列が挿入されていることがアミノ酸配列の解析から分かっていました(図2)。そして、私たちはこれまで、この挿入配列部分がATP加水分解活性の調節において重要な働きを担っており、余分なATPの消費を防ぐために加水分解活性を抑制していることを明らかにしてきました[2, 3]。一方で、2018年に相次いで発表されたホウレンソウとシアノバクテリア由来の酵素タンパク質の構造解析により、この挿入配列部分がβヘアピン構造をとり、その先端がα3β3のヘッド部分に近接していることが分かりました(図1)[1, 4]。しかしながら、ATP合成時にこの挿入配列部分のヘアピン構造がどのような役割を担っているかを調べるには、巨大なタンパク質複合体をその機能を保持した状態でプロテオリポソームに再構成し膜内外にプロトン駆動力を形成する必要があり、実験が極めて難しくてこれまで明らかにすることができませんでした。
今回、私たちは、シアノバクテリアSynechocystis sp. PCC 6803(S. 6803)から精製した完全なFoF1複合体をプロテオリポソームに再構成し、ATP合成活性やプロトンポンプ活性を解析することに成功しました。さらに、S. 6803のATP合成酵素遺伝子に部位特異的変異導入を行ってγサブユニットの変異体を作製し、βヘアピン構造の機能を生化学および生理学の両面から解析しました。この研究によって、光合成生物ではATP合成と加水分解の両方の活性がγサブユニットの特徴的なβヘアピン構造によって制御されていることが明らかとなりました[5]。
【結果】
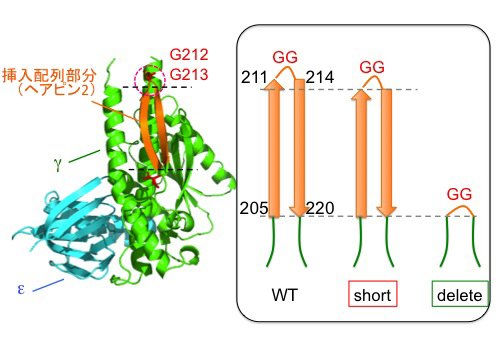
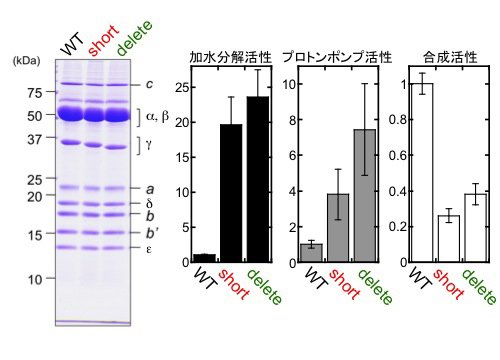
S. 6803のβサブユニットのN末端にヒスチジンタグを導入しニッケルアフィニティークロマトグラフィーによりFoF1を精製しました(図4左)。さらに、γサブユニットのβヘアピン構造の折り返し部分を短くした変異体short、および、βヘアピン構造をすべて切除したdeleteを作製し(図3)、そのFoF1を精製しました。いずれの変異導入でも複合体タンパク質が形成され、得られた複合体は、野生型のサブユニット構成と比較して顕著な差は見られませんでした(図4左)。
 |
|||
| 図3. | シアノバクテリアS. 6803のγサブユニットのヘアピン構造の折り返し部分を短くした変異体'short'と'delete'を作製した。 | ||
 |
|||
| 図4. | 野生株と変異株からFoF1複合体を精製し(左)、ATP加水分解活性、プロトンポンプ活性、ATP加水分解活性を比較した(右)。各活性は野生株に対する比を表す。 | ||
次に、ダイズ由来の脂質で調製したリポソームにFoF1を再構成しました。再構成したFoF1-プロテオリポソームのATP加水分解活性およびATP駆動のプロトンポンプ活性は、いずれの変異体においても野生型に比べて上昇しており、これまでに発表されている大腸菌によるα3β3γ発現系を用いた実験と同様の結果が得られました。さらに、ATP合成活性を測定した結果、野生型に比べていずれの変異体でも活性が減少していることが分かりました。
【まとめ】
光合成生物のATP合成酵素のγサブユニットに挿入されている特徴的なβヘアピン構造は、ATP加水分解活性を負に制御する一方で、ATP合成活性に対しては正の方向に寄与しており、合成方向へ微調整するモジュールであることが明らかとなりました(図5)。この領域はほとんど全ての光合成生物にのみ保存されており、γサブユニットによるこのようなATP合成と加水分解の活性制御は光合成生物に特有の活性制御メカニズムであると考えられます。
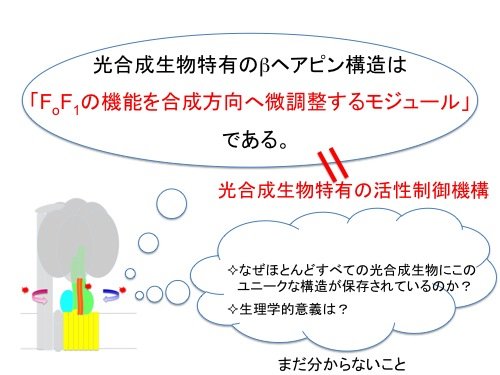 |
|||
| 図5. 本研究の概略 |
一方で、このβヘアピン構造を削った変異型のS. 6803細胞内においては、ATP量が顕著に減少するものの、細胞の生育などに明らかな表現型は見いだされませんでした。細胞レベルでは可塑性があることがわかりますが、本研究によって明らかにされた制御メカニズムが、光条件に依存して迅速に細胞内ATP濃度の変化する光合成生物にとって一体どのような生理的役割を担っているのかは今後の研究課題です。
【参考文献】
| [1] | Hahn, A., Vonck, J., Mills, D. J., Meier, T., and Kühlbrandt, W. (2018) Structure, mechanism, and regulation of the chloroplast ATP synthase. Science 360:eaat4318. |
| [2] | Konno, H., Murakami-Fuse, T., Fujii, F., Koyama, F., Ueoka-Nakanishi, H., Pack, C. G., Kinjo, M., and Hisabori, T. (2006) The regulator of the F1 motor. Inhibition of rotation of cyanobacterial F1-ATPase by the ε subunit. EMBO J. 25:4596-4604. |
| [3] | Sunamura, E. I., Konno, H., Imashimizu-Kobayashi, M., Sugano, Y., and Hisabori, T. (2010) Physiological impact of intrinsic ADP inhibition of cyanobacterial FoF1 conferred by the inherent sequence inserted into the γ subunit. Plant Cell Physiol. 51:855-865. |
| [4] | Murakami, S., Kondo, K., Katayama, S., Hara, S., Sunamura, E. I., Yamashita, E., Groth, G., and Hisabori, T. (2018). Structure of the γ-ε complex of cyanobacterial F1-ATPase reveals a suppression mechanism of the γ subunit on ATP hydrolysis in phototrophs. Biochem J. 475:2925-2939. |
| [5] | Kondo, K., Izumi, M., Inabe, K., Yoshida, K., Imashimizu, M., Suzuki, T., and Hisabori, T. (2021). The phototroph-specific β-hairpin structure of the γ subunit of FoF1-ATP synthase is important for efficient ATP synthesis of cyanobacteria. J Biol Chem. 475:2925-2939. |