最新の研究
- 2022.02.01
- 中村・岡田研究室
パラジウム触媒による1,2-アザボリン類のN-H/B-H二官能基化反応の開発
主骨格内に窒素とホウ素原子を有する芳香族化合物(以下、BN芳香族化合物)は、その特異な構造に興味がもたれるだけでなく、有機エレクトロニクス材料や生物活性物質として有望な化合物群である(図1)1)。これら機能性材料の創成には、種々の官能基を付与したBN芳香族化合物の合成法が不可欠であり、さらに不斉合成法の開発もまた重要な研究課題である。
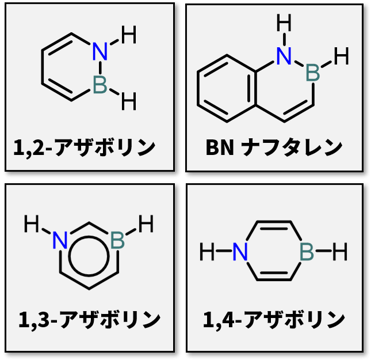 |
| 図1. BN芳香族化合物の例 |
窒素原子とホウ素原子が隣接した1,2-アザボリン類は、BN芳香族化合物のなかで最も盛んに官能基化法が開発されてきた2)。しかしながら、既存のヘテロ原子上における官能基化法では強塩基や高反応性の有機金属試薬の使用が避けられず、官能基許容性の低さが問題であった3)。これを解決するためには、温和な条件下で進行する触媒的な官能基化法が求められるが、N-HまたはB-H結合の切断を伴う触媒的な官能基化反応はわずか1例に限られていた4)。
今回我々は、パラジウム触媒存在下で1,2-アザボリン類1とビニルエチレンカーボネート(2)とを反応させると、N-H/B-H結合の切断を伴う形式的な環化付加反応が進行し、新規多環性オキサザボロリジン3が得られることを見出した(図2)5)。本反応は室温という温和な条件下で速やかに進行するため、様々な官能基が共存でき、また主骨格の異なる種々の1,2-アザボリン類を用いることが可能であった。
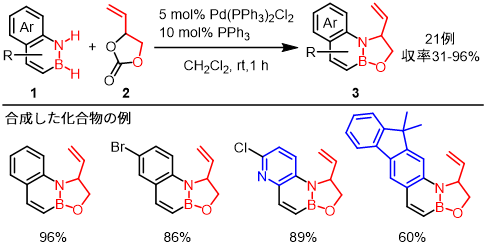 |
|
| 図2. | パラジウム触媒による1,2-アザボリン類とビニルエチレンカーボネートとの環化付加反応 |
さらに我々は、開発した手法を不斉官能基化法へと展開すべく、様々なキラル配位子についてスクリーニングを行った。その結果、キラルなホスホロアミダイト配位子L1を用いることで、高エナンチオ選択的な環化付加反応を実現し、最高95% eeで対応する生成物3を合成することに成功した(図3)。これは、1,2-アザボリン類の不斉直接官能基化反応の初めての例である。また、得られた化合物は、キラリティーを保持しつつアルケンを足掛かりとするさらなる誘導体化が可能であった。
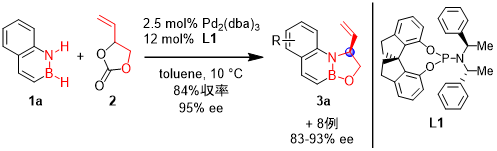 |
| 図3. 不斉環化付加反応への展開 |
以上の通り、我々は温和な条件下で進行する1,2-アザボリン類の触媒的不斉官能基化法を開発し、既存の合成手法では得難い光学活性な複素環化合物を創出した。容易に生成物を誘導体化できることから、1,2-アザボリン類を基軸とした機能性材料の開発において貢献できると期待できる。現在我々は、1,2-アザボリン類に特有の反応性に立脚した本手法を基にして、さらなる官能基化法の開発に取り組んでいる。
参考文献
| 1. | Z. X. Giustra, S.-Y. Liu, J. Am. Chem. Soc. 2018, 140, 1184-1194. |
| 2. | C. R. McConnell, S.-Y. Liu, Chem. Soc. Rev. 2019, 48, 3436-3453. |
| 3. | A. N. Lamm, E. B. Garner III, D. A. Dixon, S.-Y. Liu, Angew. Chem. Int. Ed. 2011, 50, 8157-8160. |
| 4. | A. N. Brown, L. N. Zakharov, T. Mikulas, D. A. Dixon, S.-Y. Liu, Org. Lett. 2014, 16, 3340-3343. |
| 5. | T. Morita, H. Murakami, Y. Asawa, H. Nakamura, Angew. Chem. Int. Ed. early view (2022), DOI: 10.1002/anie.202113558. |



