最新の研究
- 2022.03.01
- 北口研究室
抗体タンパク質をコイルドコイルで簡便に蛍光修飾
-高性能なセンサー抗体を酵母を用いて選択可能に-
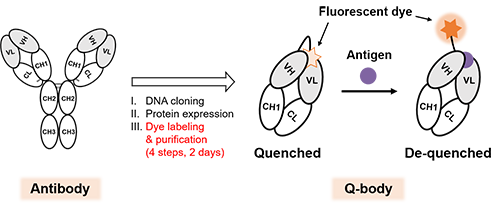
抗体を用いて試料中の微量物質を特異的に検出できる免疫測定法は、臨床診断や食品検査の現場やラボなど様々な場面・分野で汎用されている。しかしタンパク質やウイルスといった高分子抗原については高感度検出が可能な一方で、低分子抗原の検出は難しい場合が多い。我々が以前見出した蛍光標識抗体Quenchbody (Q-body) (図1)[文献1] は、抗原不在時には消光 (クエンチ) 状態にある蛍光色素が抗原結合に伴って蛍光輝度を上昇させる原理に基づき、標的抗原量を高分子・低分子問わず高感度かつ簡便に計測可能である。その取り扱いの容易さから迅速診断のコア技術として応用と社会実装が期待されている。しかし、現行のQ-body構築法は手間と時間を要するという問題があり、Q-bodyの抗原応答向上に必要な検討を効率よく行うために抗体断片を迅速にQ-body化できる手法が必要とされていた。
 |
|
| 図1. | 抗体とQ-bodyの模式図。Q-bodyは抗原結合に伴って蛍光強度が増大するため標的抗原を高分子・低分子問わず高感度に検出可能である。ただし、組換え抗体断片からQ-bodyを構築するには手間と時間 (4工程2日) がかかる。 |
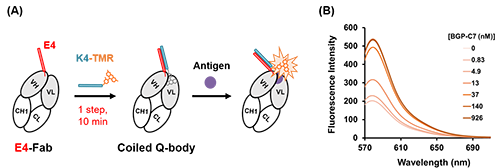
我々は今回、混ぜるだけで迅速に強固なヘテロ二量体(コイルドコイル)を形成するペプチドペアE4/K4に着目し、抗体断片の迅速なQ-body化に成功した[文献2]。すなわち、H鎖N末端にE4を融合させたbone Gla protein (BGP, 骨代謝マーカーとして知られる) を認識するFab断片と、蛍光色素TAMRAで修飾されたK4を混合することで、精製操作を行うことなく1工程で10分以内にQ-bodyが得られることを見出し、このようにして構築されるQ-bodyをCoiled Q-body (CQ-body) と命名した (図2)。
 |
|
| 図2. | (A) コイルドコイル形成ペプチドE4/K4を用いたQ-body構築の模式図。E4-FabとK4-TMRを混ぜて10分間静置するだけで精製することなくQ-bodyが得られる。 (B) CQ-bodyに抗原BGP-C7 (BGPのC末7アミノ酸ペプチド) を添加したときの蛍光スペクトル。 |
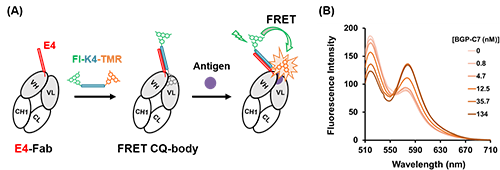
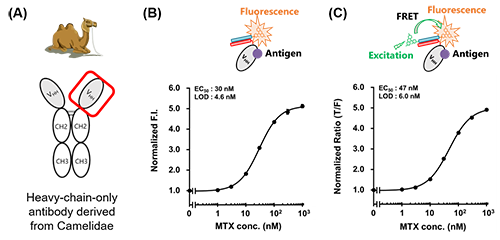
さらに、K4-TAMRAのN末端側にフルオレセイン(Fl)を導入することで、蛍光共鳴エネルギー移動FRETに基づくレシオ検出が可能なFRET CQ-bodyの構築にも成功した (図3)。興味深いことに、抗原依存的なTAMRAの移動に起因すると思われるドナー蛍光の減少とアクセプター蛍光の上昇が観察され、蛍光色の変化で抗原を検出できる可能性が示唆された。このようなCQ-bodyあるいはFRET CQ-bodyはFab断片だけでなく抗がん剤メトトレキサート(MTX)を認識するラクダ科動物由来重鎖抗体断片ナノ抗体 (MTX VHH)を用いても、従来法で構築されたQ-bodyに匹敵する応答で構築できる事が実証され、本法の汎用性が示されたといえる (図4)。
 |
|
| 図3. | (A) 二色標識されたK4ペプチドを用いたFRET CQ-body構築の模式図。 (B) FRET CQ-bodyに抗原BGP-C7を添加したときの蛍光スペクトル。 |
 |
|
| 図4. | ラクダ科動物由来重鎖抗体の模式図 (A) とVHHを基に構築されたCQ-body (B) あるいはFRET CQ-body (C) によるMTXの検出。 |
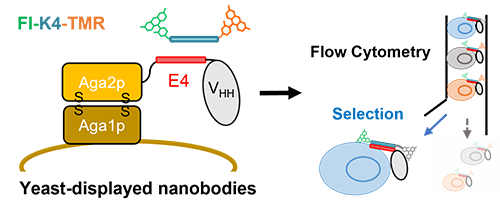
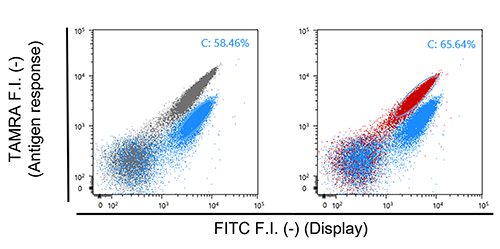
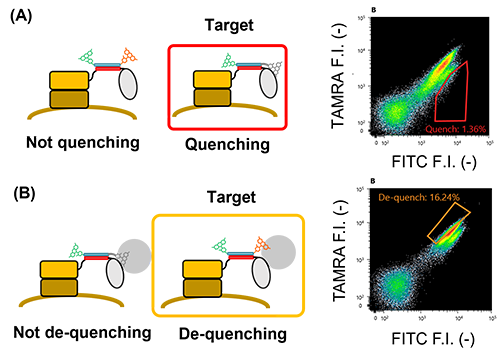
そこで次に、Wittrupらが開発した酵母表層提示系[文献3]を用いて、FRET CQ-bodyを酵母表層で構築し、Q-bodyとして有望な抗体の選択を試みることとした (図5)。まずE4をN末端に付加したMTX VHHを酵母表層に提示しFI-K4-TMRと反応させて酵母表層での CQ-body構築を試みたところ、フローサイトメトリーでTAMRA/Fl 比の変化が確認され、クエンチおよび蛍光回復を評価できた (図6)。さらに約30種のヒト血清アルブミン (HSA) 認識ナノ抗体群をモデルとして選択実験を行ったところ、Q-bodyとして機能するナノ抗体が選択された (図7)。すなわちこの方法でQ-bodyとしての応答が明らかでない複数の抗体断片について、フローサイトメトリーで同時に応答を評価し、さらに高い応答を示す抗体断片を直接選択することに成功した。しかし選択された抗体断片は大腸菌を用いて発現・精製すると、Q-bodyにした際の蛍光応答が酵母表層と比べて応答が小さくなってしまうという問題が生じた。
 |
|
| 図5. | 酵母表層でのFRET CQ-bodyの構築およびフローサイトメトリーによる選択の模式図。 |
 |
|
| 図6. | 酵母表層で構築したE4-MTX VHH Q-bodyのフローサイトメトリー上でのプロット。(A) 抗原非存在下におけるE4ペプチドのみ (灰色のプロット) あるいはE4-MTX VHH (水色のプロット) の比較。 (B) 抗原非存在下 (水色のプロット) あるいは抗原存在下 (赤色のプロット) におけるE4-MTX VHH の比較。 |
 |
|
| 図7. | HSA認識ナノ抗体群を用いたフローサイトメトリーによる有望なQ-bodyの選択。 (A) 抗原非存在下におけるクエンチを示すナノ抗体の選択 (赤色ゲートを使用)。 (B) 抗原非存在下における脱クエンチを示すナノ抗体の選択 (黄色ゲートを使用)。 |
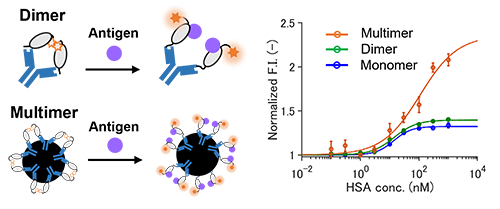
そこで、構築したQ-bodyをIgG抗体および精製用ビーズを用いて多量体化し、酵母表層を模倣してみたところ、特に精製用ビーズを用いて多量体化した際には蛍光応答が増大することが確認された (図8)。すなわち、酵母表層提示系を用いてQ-bodyに適した抗体断片が確かに選択されていること、そして多量体化によってQ-bodyの蛍光応答を向上できる場合があることが示された[文献4]。
 |
|
| 図8. | 選択されたHSA認識ナノ抗体を用いた単量体、二量体および多量体化状態のQ-bodyによるHSAの検出。 |
以上の結果は、Q-bodyとして有望な抗体断片を効率よく選択できるだけでなく、本手法を他の蛍光分子センサーの構築に応用することで、より広範な分子を高感度に検出できる可能性を示している。
参考文献
| [1] | R. Abe, H. Ohashi, I. Iijima, M. Ihara, H. Takagi, T. Hohsaka, H. Ueda. J. Am. Chem. Soc. 133, 17386-17394 (2011) |
| [2] | T. Yasuda, A. Inoue, T. Kitaguchi and H. Ueda. Chem. Commun. 57, 8206-8209 (2021). |
| [3] | T. Border & D. Wittrup, Nat. Biotechnol. 15, 553-557 (1997). |
| [4] | A. Inoue, T. Yasuda, B. Zhu, T. Kitaguchi, A. Murakami, H. Ueda, Sci. Rep. 11, 22590 (2021). |



