最新の研究
- 2022.08.01
- 吉沢・澤田研究室
ペプチド鎖に秘められたトポロジー
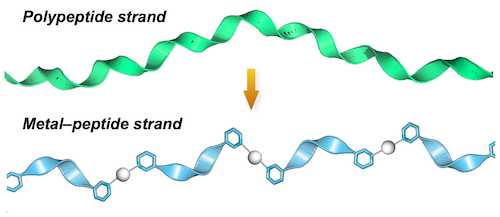
柔軟なヒモ状の材料を編み込むものづくりは、マクロな世界ではよく見かけますが、ナノメートルの極微の世界では未開拓の技術です。高分子鎖がランダムに絡まり合う現象はありますが、秩序ある絡まり構造を作り出すことは困難とされてきました。ところが、私たちは近年、金属イオンで連結されたペプチド鎖が高度な絡まり構造を自発的に形成する性質があることを発見しました[1]。これは、生体のタンパク質(ポリペプチド鎖)を人工模倣しようと、短いペプチドフラグメントを金属イオンによって伸長するアイデア(図1)を試していた際に見つかった現象です。
|
|
|
|
図1 金属連結ペプチド鎖の設計
|
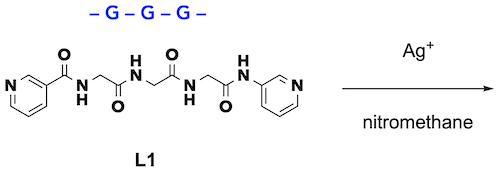
まず、最も単純なアミノ酸であるグリシン(G)の3残基配列の両末端に3-ピリジル基を導入し、この二座ペプチド配位子L1と直線二配位金属の銀イオンを有機溶媒中で錯形成しました(図2)。
|
|
|
|
図2 トリペプチド配位子L1の錯形成
|
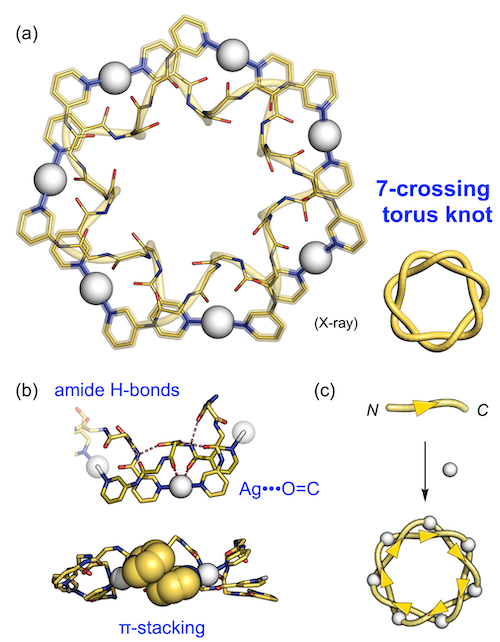
得られた溶液から結晶化を行い、構造を単結晶X線構造解析によって調べると、(Ag•L1)の連なった分子鎖が結び目を作っていることが明らかとなりました(図2a)[2]。二重らせんがドーナツ状に閉じたこの構造は、「7交点トーラス結び目」と呼ばれる絡まりトポロジーを持ちます。この構造は、ペプチド鎖間のアミド水素結合をはじめ、ピリジン環同士のπスタッキングや銀イオンとペプチド鎖のカルボニル酸素の弱い配位結合といった弱い相互作用が協働的に働くことによって形成したと考えられます(図2b)。そのため、二座配位子L1には、ペプチドのN,C末端の区別がありますが、結び目の構造中では全て向きが揃っており(銀イオンを介して全てhead-to-tail様式、図2c)、その自己集合過程には顕著な立体選択性が発現しています。
 |
|
| 図3 |
(a)7交点トーラス結び目構造、(b)結び目構造を安定化するさまざまな弱い相互作用、(c) 立体規則性
|
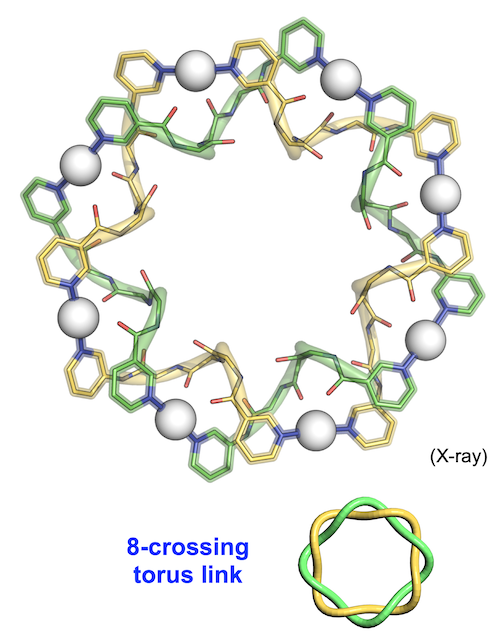
1H NMR測定により溶液状態を調べると、同じく高対称性をもつ自己集合構造がもう一つ存在することが確認されました。結晶化の際に用いる銀イオンの対アニオンを変えることで、もう一方の構造の結晶化にも成功し、それが「8交点トーラス絡み目」構造であることを明らかにしました(図4)。二重らせんがドーナツ状に閉じている点は7交点結び目と同様であり、偶数の交点数をもつために一つの大環状構造が絡まった「結び目」ではなく、二つの大環状構造が絡まった「絡み目」と数学的には分類されます。Ag7(L1)7組成の結び目とAg8(L1)8組成の絡み目では、ペプチド配位子の配座はほぼ同じであるため両構造のエネルギー差は小さく、溶液では平衡混合物として得られたことが分かりました。
 |
|
|
図4 8交点トーラス絡み目構造
|
分子構造でトーラス結び目・絡み目を合成する試みは長年行われてきましたが、これまでの成功例では交点数3〜6までに留まっており、7と8交点は初の合成例となりました。また用いたペプチド配列は側鎖を持たないグリシンであることから、ペプチド鎖自体に潜在的に絡まり合う性質があると解釈することもできます。自然界のポリペプチド鎖との違いは、分子鎖の至るところに可逆的な配位結合があるために、鎖のくぐり抜けが可能となっている点にあると私たちは考察しています。
続いて、AGGのペプチド配列を試してみました(A:アラニン)。この配列の配位子(L2)からも銀イオンとの錯形成により、7交点トーラス結び目と8交点トーラス絡み目構造が得られました。結晶構造では、トーラス空孔内にアラニンのメチル基側鎖が集積した様子が確認されました(図5a)。そこで、この空孔内の側鎖の立体障害を利用することにより、トーラス結び目構造を拡張できると考えました。エチル基側鎖をもつAbuGG(Abu: 2-アミノ酪酸)配列の配位子L3からは、予想通り拡張された9交点トーラス結び目分子が新たに生成しました(図5b)[3]。
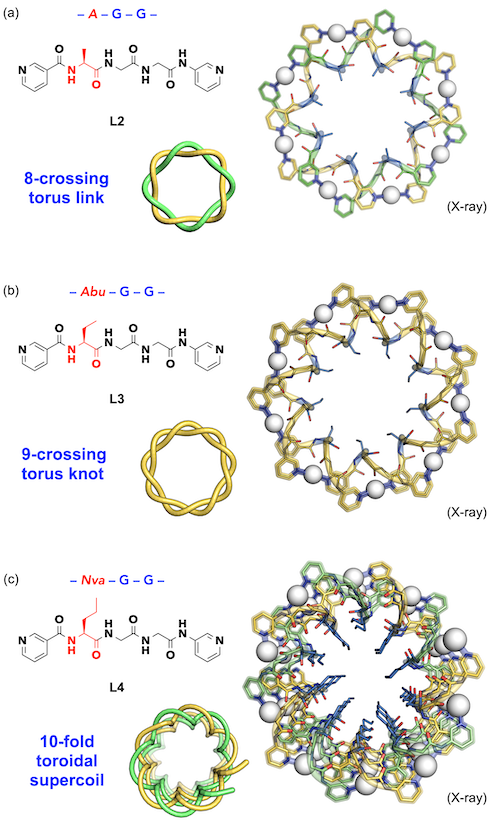 |
|
| 図5 |
トーラス結び目構造の拡張: (a)Me基側鎖による8交点トーラス絡み目構造、(b)Et基側鎖による9交点トーラス結び目構造、(c)nPr基側鎖によるトロイダル超らせん構造
|
さらに、n-プロピル基側鎖をもつNvaGG(Nva:ノルバリン)配列の配位子L4を試したところ、溶液中では10交点トーラス絡み目構造の生成が示唆されたものの、結晶構造では、予想外のトロイダル超らせん構造(無限の発散構造)が確認されました(図5c)。これは、二重らせんが(Ag•L4)の10個分を1ピッチとする超らせん構造であり、10交点トーラス絡み目構造が一箇所で開環して無限に連なることにより生成したものと考えられます。立体なひずみにより、「超分子の開環重合」が起きたと考えられます。
以上の実験により、金属連結ペプチド鎖が高度な絡まり構造を生むことを明らかにしました。自然界では高度に絡まった構造として、DNAの環状プラスミドや超らせん構造がよく知られています。DNAが絡まり構造を作る際には、トポイソメラーゼという酵素が働くことによって鎖の一時的な切断と再結合が行われ、鎖がうまくくぐり抜けるメカニズムが働いています。今回の金属連結ペプチド鎖では、可逆な配位結合がその役割を果たしており、効率的に絡まり構造を作り出していると言えます。今回ご紹介した例では、グリシンをベースとする単純なペプチド配列を用いましたが、プロリンを多用したペプチド配列を用いるとさらに交点数の大きい複雑な絡まり構造(多面体絡み目)が得られます[4,5]。絡まり構造に特徴的な構造ダイナミクスの解明や、トポロジー不斉を生かしたナノ空間の活用が今後期待されます。
| [1] | Bull. Chem. Soc. Jpn. 2021, 94, 2342. (https://doi.org/10.1246/bcsj.20210218) |
| [2] | Chem 2020, 6, 294. (https://doi.org/10.1016/j.chempr.2019.12.009) |
| [3] | J. Am. Chem. Soc. 2021, 143, 16734. (https://doi.org/10.1021/jacs.1c08094) |
| [4] | Nat. Commun. 2019, 10, 921. (https://www.nature.com/articles/s41467-019-08879-7) |
| [5] | Nat. Commun. 2019, 10, 5687. (https://www.nature.com/articles/s41467-019-13594-4) |