最新の研究
- 2022.10.01
- 田中・吉田研究室
単細胞性シアノバクテリアSynechocystis sp. PCC 6803における新規硫酸多糖シネカンの合成制御機構
【背景】
酸素発生型の光合成をおこなう原核生物であるシアノバクテリア(藍藻)は、酸素や有機化合物を環境に供給する重要な生物である。また、近年はその光合成能力を活用した環境負荷の少ない物質生産のホスト生物としても注目されている。自然界においてシアノバクテリアは湖、小川、温泉、海、陸上などの幅広い環境に生息しており、微生物マット、群体、ブルーム(アオコ)などの多様なバイオフィルムを形成する。シアノバクテリアのバイオフィルムの主要構成要素の一つは、彼らの作る細胞外多糖(EPS)である。しかしながら、シアノバクテリアにおけるEPSの合成制御機構とその生理機能には未解明の部分が多い。そこで我々はその解明に取り組んできた1。
シアノバクテリアは非常に多様なEPSを作るが、その中でもシアノバクテリアに特異的なEPSとして硫酸多糖がある2。硫酸多糖とは、硫酸基で修飾された多糖であり、保水性や粘性をもつものが多く知られている。自然界では、動物のグルコサミノグリカン(コンドロイチン硫酸など)、真核藻類の細胞壁多糖(カラギーナンなど)、そしてシアノバクテリアのEPSとして存在する。興味深いことに硫酸多糖を作るバクテリアは、シアノバクテリア以外には殆ど知られていない。一方でシアノバクテリアには様々な組成の硫酸多糖が存在しており、群体などのバイオフィルムの形成や生理機能に関わると考えられている。また、シアノバクテリア由来硫酸多糖にはスピルリナ由来のスピルランや、スイゼンジノリ由来のサクランのように、医薬品や化粧品、繊維の材料として研究されているものがある3。このようにシアノバクテリア由来硫酸多糖は基礎と応用の両方の面から重要なEPSだが、それらの合成制御機構は未解明だった。
本研究で我々はシアノバクテリア由来の新規硫酸多糖シネカンを発見し、その合成と制御に関わる遺伝子群を網羅的に同定した4。なお、詳細なデータは論文に記載されているため、本文では一部のみを抜粋して紹介する。
【結果】
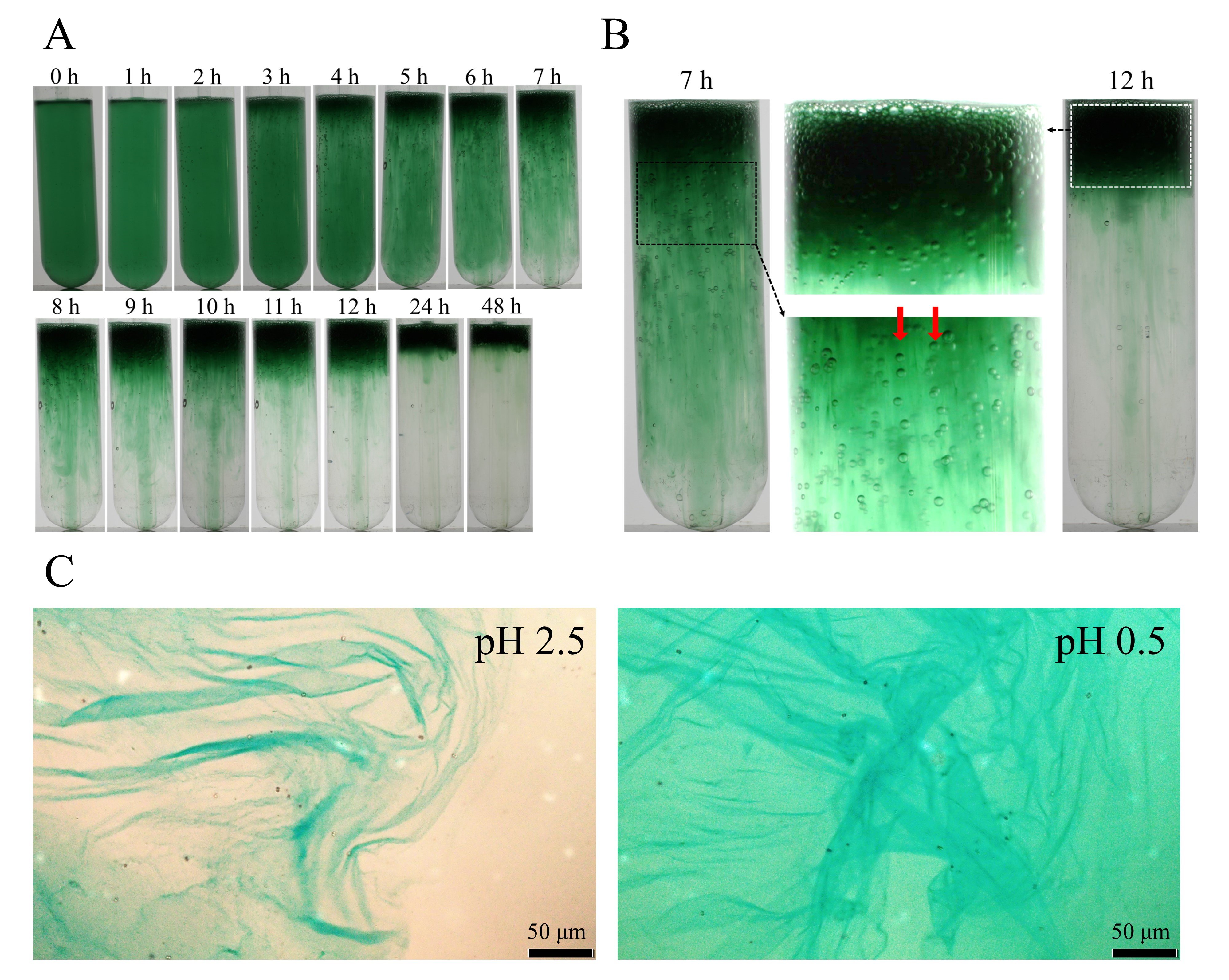
シアノバクテリア硫酸多糖の合成制御機構の研究には、硫酸多糖を合成し且つ形質転換が可能な種が必要であった。最初に我々は、単細胞性シアノバクテリアの一種で長年モデル生物として研究に使われてきたSynechocystis sp. PCC 6803(以下S.6803)のサブストレインの1つが培養液の静置により粘性の細胞塊を液面に形成する現象を発見した(図1A、B、動画1)。また、この粘性物質がEPSであり硫酸多糖を含むことをアルシアンブルー染色と組成分析により明らかにし(図1C)、この硫酸多糖をシネカンと命名した。
 |
|
| 図1. |
A. S.6803の静置培養液の経時変化と粘性細胞塊形成。B. 粘性細胞塊の拡大像。粘性細胞塊の形成過程では、培地中の粘性成分に細胞と光合成により生じた気泡がトラップされ、ともに浮上していた。C. 分画した粘性EPSのアルシアンブルー染色像。酸性多糖が染まるpH2.5条件と硫酸多糖のみが染まるpH0.5条件の両方で青色に染まった。
|
|
動画.1S.6803の粘性細胞塊の様子。
|
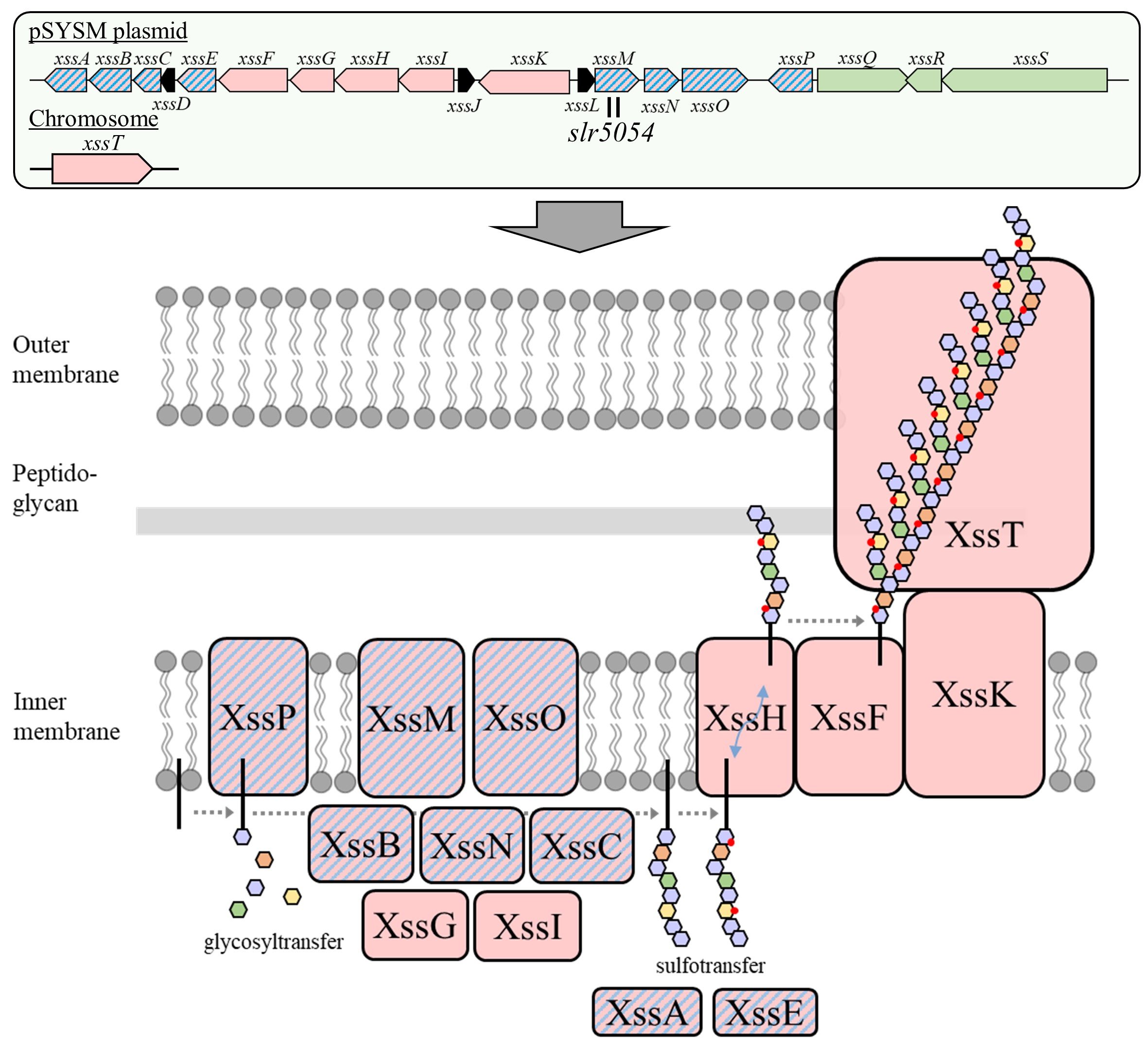
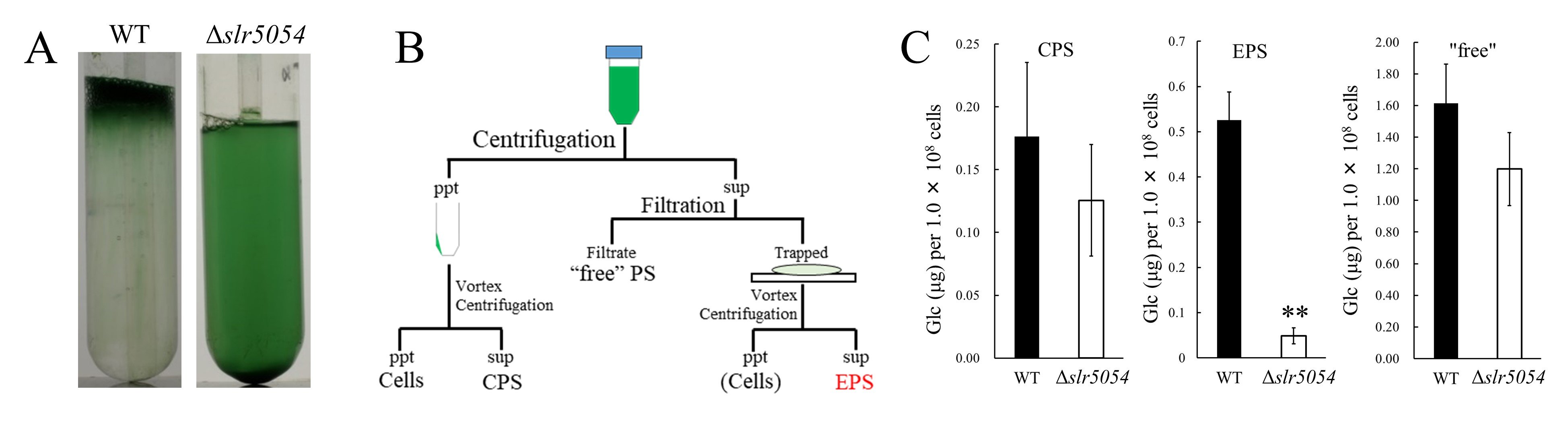
次に我々はシネカン合成遺伝子の同定をおこなった。バクテリアのEPS合成系は、その合成機構と構成タンパク質から大きく3種類に分けられるが、どの系にも膜貫通性の糖転移酵素が必須である5。そこで我々はS.6803に存在する「膜貫通領域を持つ糖転移酵素」の破壊株を複数作製し、その表現型を解析した(図2A)。その結果、slr5054という遺伝子の周辺を破壊した株でのみ、粘性細胞塊が形成されなかった。また、野生株(WT)とslr5054破壊株(Δslr5054)それぞれから、粘性EPSと細胞表在性多糖(CPS)、低分子EPSを分画し定量したところ、Δslr5054では粘性EPS画分の量のみが著しく減少していた(図2B、C)。これらの結果から、slr5054がシネカン合成に必要な遺伝子の1つであることが明らかになった。slr5054はS.6803の持つ巨大プラスミドpSYSM上の大きな遺伝子クラスター内に存在した(図3)。このクラスターはバクテリアのEPS合成系の1つであるWzx/Wzy型の遺伝子群と硫酸基転移酵素遺伝子、後述する遺伝子発現制御関連遺伝子の計19個の遺伝子で構成されていた。そこで、個々の遺伝子の破壊株を作製し表現型を解析したところ、それらの殆どはシネカン合成に必要であった。我々はこれらのシネカン合成遺伝子群をxss (extracellular sulfated polysaccharide biosynthesis)と命名した。
 |
|
| 図2. |
A. 48時間静置培養したS.6803野生株 (WT)とΔslr5054の培養液。B. 多糖分画法のフローチャート。EPS:シネカンを含む粘性EPS、CPS:細胞表在性多糖、" free" PS:低分子EPS。C. Bの各画分中の総糖量。エラーバーはSDに基づく(CPS, n = 6; others, n = 3; ** P < 0.005).
|
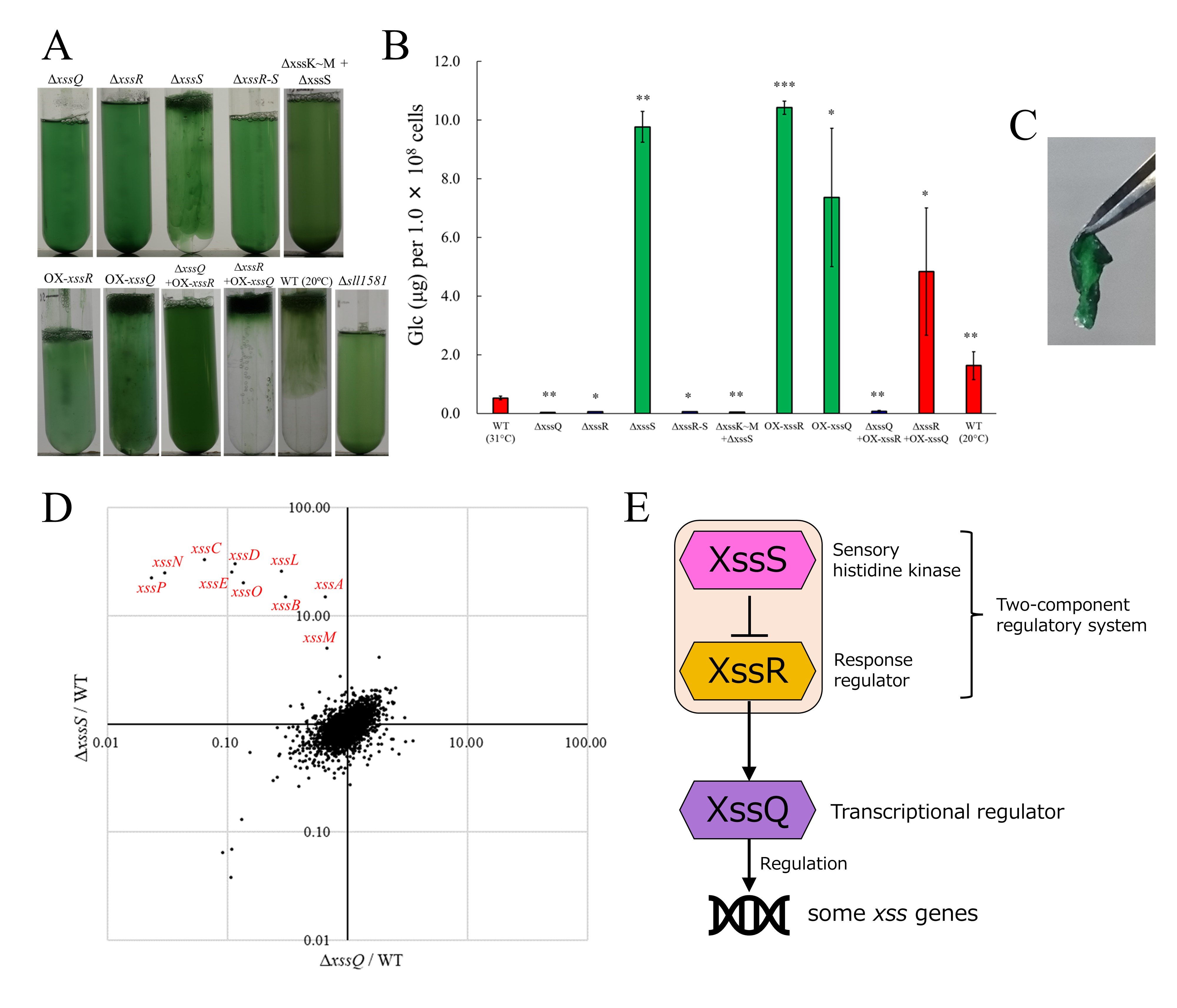
pSYSM上のxss遺伝子クラスター内には、転写制御因子様遺伝子xssQ、バクテリアに一般的な二成分制御系の構成要素であるセンサーヒスチジンキナーゼ遺伝子xssS、レスポンスレギュレーター遺伝子xssRも存在した。xssQとxssRの破壊株(ΔxssQ、ΔxssR)は粘性細胞塊を形成せずEPSをほとんど蓄積しなかった(図4A、B)。一方でxssSの破壊株(ΔxssS)では培養液全体が粘性細胞塊のようになりEPS蓄積量がWTの約19倍にまで増加した。xssQとxssRの過剰発現株(OX-xssQ、OX-xssR)もΔxssSと同様の表現型を示し、寒天培地上ではシート状の強固なバイオフィルムを形成した(図4C)。RNA-seq解析によりWTとΔxssQ、ΔxssS間で遺伝子の転写レベルを比較したところ、WTに比べてΔxssQで転写レベルが低下しΔxssSで転写レベルが増加した遺伝子、すなわちシネカン合成能と正の相関のあった遺伝子は一部のxss遺伝子であった(図4D)。これらの結果から、XssSRQが一部のxss遺伝子の転写制御を介してシネカン合成を制御していること、XssSがシネカン合成に抑制的に働いていることが明らかになった。
【考察・展望】
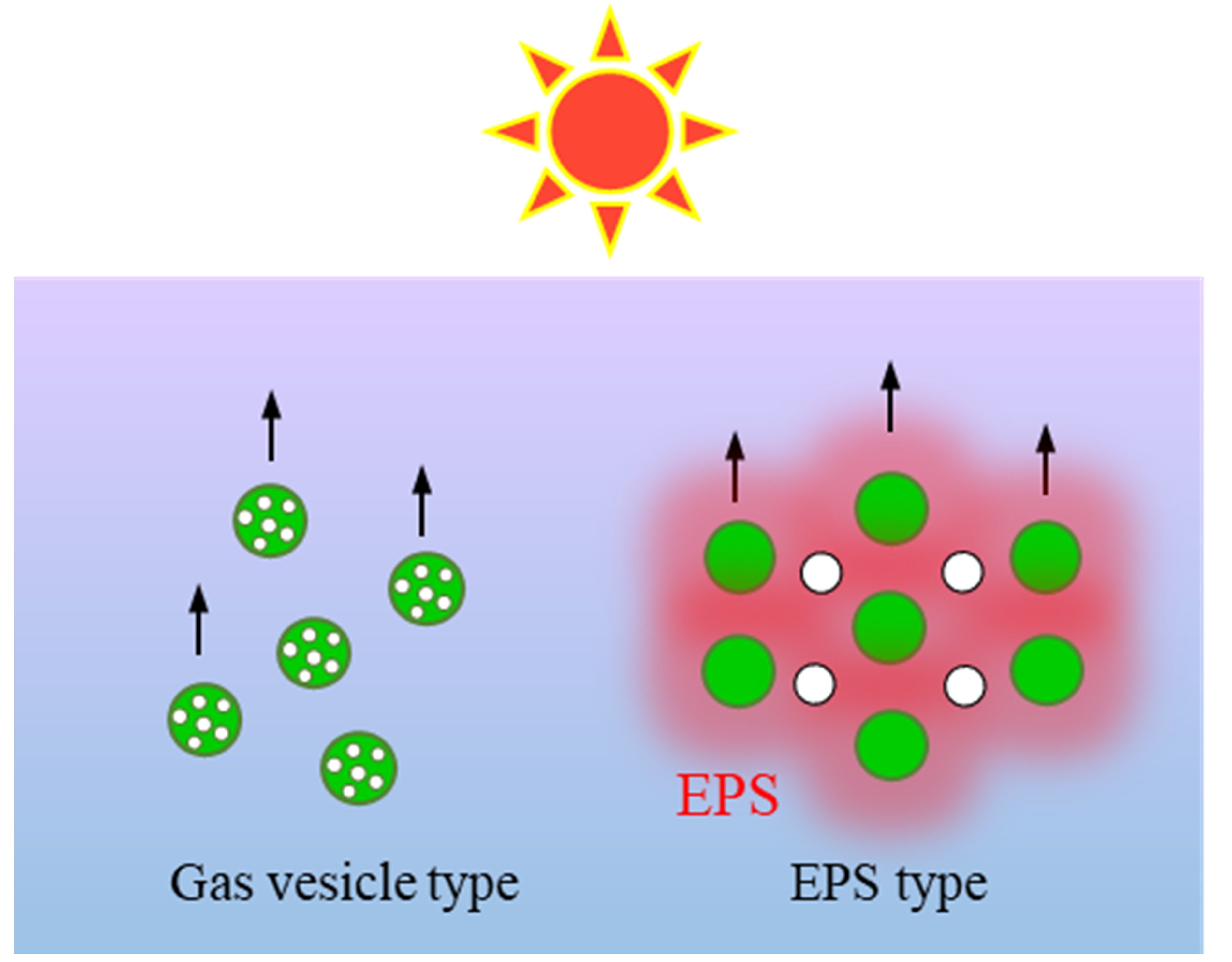
S.6803は何のためにシネカンを作るのだろうか。我々はその1つの可能性としてブルーム形成を考えている。シアノバクテリアは光が豊富な環境である水面側へと浮上しブルームを形成することが知られており、その浮力は主に細胞内のガス胞によりもたらされる。一方で本研究において、S.6803はガス胞を持たないにも関わらず、細胞外のシネカンにトラップされた気泡の浮力によりブルーム様の粘性細胞塊を形成した。このことから、シアノバクテリアブルーム形成の新たな仕組みとして、細胞外のEPSと気泡によるものがあると考えている(図5)。しかしながらこれはまだ仮説の段階である。また、XssSRQによる転写制御機構の詳細や、XssSRQが感知する環境刺激等に関しても明らかでない部分が多い。これらについて今後研究を進めることで、シネカンの機能とS.6803の生態への理解を深めたい。本研究では世界で初めてシアノバクテリアの硫酸多糖の合成と制御に関わる遺伝子群を網羅的に解明したが、この成果はS.6803以外のシアノバクテリアの硫酸多糖研究への貢献も期待できる。例えば、xss遺伝子の情報をもとに他のシアノバクテリアのゲノム情報を調べることで、硫酸多糖合成関連遺伝子を推定することができた。また、xssSRQ、特にxssQは一定数のシアノバクテリアのゲノム上に存在しており、それらの種でも遺伝子発現の制御機構として機能していると推測される。
 |
|
| 図5. |
シアノバクテリア細胞の2つの浮上モデル。Gas vesicle typeは細胞内のガス胞に溜められたガスの浮力を利用して浮上する。EPS typeはEPSにトラップされた気泡の浮力を利用して浮上すると考えられる。.
|
本研究成果は応用研究への活用も期待できる。背景でも触れたように、シアノバクテリアは光合成により二酸化炭素を固定して様々な物質を生産することが可能であり、その中にはEPSも含まれる。そして、シアノバクテリア硫酸多糖は産業上有用な物質として期待され研究されている。そこで、xssSの破壊によりシネカン生産性を向上させられたように、本研究を遺伝子改変により硫酸多糖の生産性や組成を改変する研究へと繋げていきたい。また、シネカンが他のシアノバクテリア硫酸多糖のように産業上有用な多糖であるかは、現時点ではほぼ未解明であるため、今後明らかにしたいと考えている。
| 1. | Maeda K, Tamura J, Okuda Y, Narikawa R, Midorikawa T, Ikeuchi M. 2018. Genetic identification of factors for extracellular cellulose accumulation in the thermophilic cyanobacterium Thermosynechococcus vulcanus: proposal of a novel tripartite secretion system. Molecular Microbiology 109:121-134 |
| 2. | Pereira S, Zille A, Micheletti E, Moradas-Ferreira P, De Philippis R, Tamagnini P. 2009. Complexity of cyanobacterial exopolysaccharides: composition, structures, inducing factors and putative genes involved in their biosynthesis and assembly. FEMS Microbiology Reviews 33:917-941 |
| 3. | Okajima MK, Bamba T, Kaneso Y, Hirata K, Fukusaki E, Kajiyama Si, Kaneko T. 2008. Supergiant ampholytic sugar chains with imbalanced charge ratio form saline ultra-absorbent hydrogels. Macromolecules 41:4061-4064 |
| 4. | Kaisei Maeda, Yukiko Okuda, Gen Enomoto, Satoru Watanabe, Masahiko Ikeuchi. Biosynthesis of a sulfated exopolysaccharide, synechan, and bloom formation in the model cyanobacterium Synechocystis sp. strain PCC 6803. eLife, 2021, 10:e66538. |
| 5. | Schmid J, Sieber V, Rehm B. 2015. Bacterial exopolysaccharides: biosynthesis pathways and engineering strategies. Frontiers in microbiology 6:496. DOI: 10.3389/fmicb.2015.00496, PMID: PMC4443731 |