最新の研究
- 2022.11.08
- 西山・三浦研究室
ポリベタインで被覆された脂質ナノ粒子による核酸デリバリーとがん治療への展開
COVID-19のワクチンとしてmRNAが使われて以来、核酸治療薬は益々注目を集めております。しかし、mRNAやsiRNAなどの核酸は非常に分解し易い性質を持っており、そのままでは医薬品として使用することはできません。この問題を解決する手段として、人工的なナノカプセルの中に核酸医薬品を入れて、それらの安定性と有効性を高める方法があります。例えば、上述のCOVID-19用のワクチンでは脂質ナノ粒子(LNP)がナノカプセルとして使われていました。一方で、LNP自身の安定性も医薬品としての使用を考えると高くする必要があります。その方法としては、一般的にポリエチレングリコール(PEG)に代表される生体適合性高分子によってLNPの表面を化学修飾する方法がとられてきました。しかしながら、近年ではPEGに由来する免疫反応やアナフラキシーショックを含むアレルギーなどの問題が指摘されており、PEGに替わる新しい高分子で修飾されたLNPが求められるようになってきました。今回、我々は当研究室で新たに開発されたポリベタインで被覆されたLNPを調製し、そのがん治療への応用について紹介します。
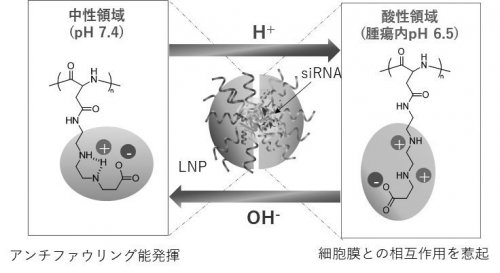
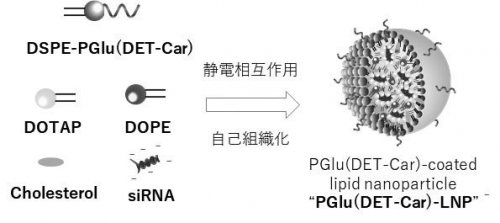
一般的に体の中や疾患部位のpHはそれぞれ異なります。血中や正常組織内はpH 7.4に保たれているのに対して、腫瘍組織内は嫌気呼吸の亢進によって過剰な乳酸産生があり、その結果、弱酸性(pH~6.5)に保たれています。我々はこの腫瘍内弱酸性環境に応答する化学構造として、エチレンジアミン(1,2-ジアミノエタン)をポリアミノ酸の側鎖に導入した新しい高分子"PGlu(DET-Car)"を開発しました。(文献1,2)。この分子設計では、側鎖のエチレンジアミン構造が2つの離れたpKa値(6.3と9.1)を有しているため、中性条件では、モノプロトン化状態であるのに対し、腫瘍内に相当する弱酸性条件ではジプロトン化が進行します(図1)。これにより、この新規pH応答性高分子ベタインPGlu(DET-Car)は、正常組織のpH7.4 においては正味の電荷が中性であることでアンチファウリング能(ここでは血中などの生体物質との相互作用を抑制する機能)を発揮する一方で、腫瘍内弱酸性pH(~6.5)では、正味の電荷がカチオン性へと転換し、アニオン性の細胞膜と相互作用を起こします(図1)。今回、我々はこのpH応答性高分子ベタインへ脂質(DSPE)を結合させたDSPE-PGlu(DET-Car)を合成し、DOTAP、DOPEと混ぜ合わせることで、治療薬にもなるsiRNAを内包させたLNP "PGlu(DET-Car) LNP"を調製することに成功しました(図2)。
 |
|
| 図1. |
pH応答性ポリベタインとそれらで被覆されたsiRNA内包LNPのpH変化に対する機能発現
|
 |
|
| 図2. |
PGlu(DET-Car)で被覆されたpH応答性siRNA内包LNP [PGlu(DET-Car) LNP]
|
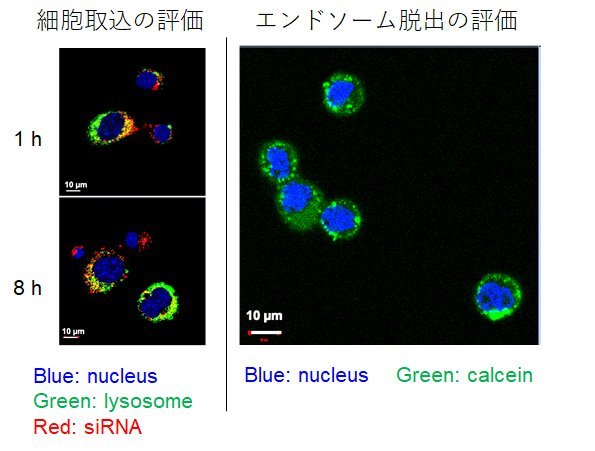
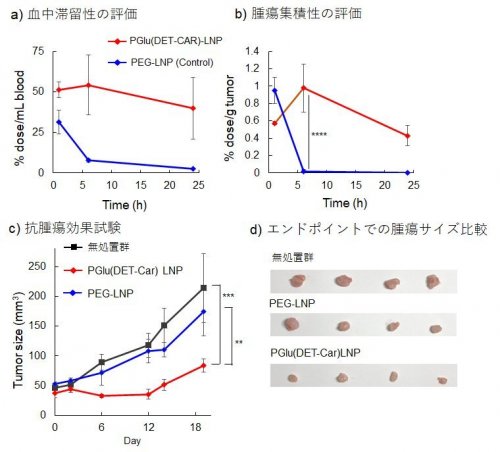
siRNAなどの核酸医療では、核酸が効率的に血中から腫瘍組織へと移行し、がん細胞に取り込まれた後にエンドソームから細胞質へと脱出する必要がありますが、従来までのPEGによるLNP修飾は、エンドソーム脱出を著しく阻害する問題(PEGジレンマ)がありました(文献3)。この点に於いて我々が調製したPGlu(DET-Car) LNPは大腸がん細胞株(CT26)に対して経時的に取り込まれ、かつ、エンドソームから効率的に脱出することが確認されています(図3)。また、卵巣がん細胞株SKOV3-lucをマウスの皮下へ移植したモデル動物を用いた体内動態試験では、比較対象であるPEG-LNP群に対してPGlu(DET-Car) LNPの方が長い血中滞留性を有することや腫瘍への選択的な集積性を示すことを明らかにしました(図4a-b)。さらに、固形がんの腫瘍形成に関与するPLK1をノックダウンするsiPLK1を内包させたPGlu(DET-Car) LNPをマウスの尾静脈から投与した腫瘍増殖抑制試験では、有意に治療効果を発揮することが確認できております(図4c-d)。今回、我々が用いたPGlu(DET-Car)は生分解性も持ち合わせております。非分解性のPEGが体内へ長期蓄積することやPEGに対する抗体の産生も解決すべき課題と話題になっている中、このような高分子ベタインや新規高分子の開発が加速されれば、生体反応を積極的に回避できる革新的なドラッグデリバリーの創製が可能になり、核酸医療の発展とその実臨床への応用へ大きく前進できるものと期待されます。
 |
|
| 図3. |
大腸がん細胞株CT26に対するin vitro試験
|
 |
|
| 図4. |
CT26マウス皮下移植モデルを用いた体内動態試験と腫瘍増殖抑制試験
|
| 1. | Ranneh A -H, et al : Angew. Chem. Int. Ed. 57, 5057 (2018). |
| 2. | Awaad A, et al : J. Control Release. 346, 392 (2022). |
| 3. | Harada H, et al : Biol. Pharm. Bull., 36(6), 892 (2013). |



