最新の研究
- 2023.07.21
- 中村・岡田研究室
難治性悪性脳腫瘍の中性子捕捉治療に有望な薬剤の開発
ホウ素中性子捕捉療法(BNCT)は、がん細胞が取り込んだホウ素-10(10B)と熱中性子の核反応によって、がん細胞のみを選択的に殺傷する治療法として近年注目を集めています。特に、外科療法や通常の放射線療法で治療が困難な、悪性度の高いグリオーマに代表される難治性悪性脳腫瘍の新たな治療法としてBNCTには大きな期待が寄せられています。現在のところ、4-borono-L-phenylalanine(L-BPA)が、薬事承認された唯一のBNCT用ホウ素薬剤ですが、グリオーマに対して十分な腫瘍治療効果を得るには、L-BPAよりも高いグリオーマ細胞へのホウ素取り込み能を有する薬剤の開発が望まれています。今回我々は、脳腫瘍の1つであるグリオーマの中でも悪性度が高く、最も治療が難しいがんとされるグリオブラストーマ細胞に高い取り込み能を示すBNCT用ホウ素薬剤PBC-IPを新たに開発しました。PBC-IPを用いたBNCTは、グリオーマおよびグリオブラストーマ動物モデルに対して極めて高い治療効果を発揮しました。以下にその詳細を紹介します。
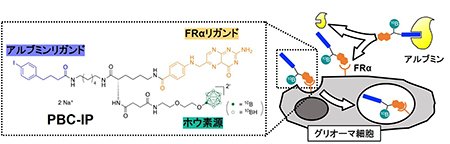
これまでに我々は、葉酸受容体α(FRα)がグリオーマ細胞に高発現することに着目し、FRαのリガンドである葉酸の部分構造(pteroyl基)と、12個のホウ素原子を含むdodecaborateが結合したPBCs[1]を開発していますが、動物個体に投与した際の血中滞留性が低いことが問題となっていました。一方で、血中のアルブミンと結合しやすいiodophenyl基とdodecaborateを結合させることで、血中アルブミンのenhanced permeability and retention(EPR)効果を利用してホウ素薬剤の血中滞留性と腫瘍集積性を高めることにも成功しています[2]。上述の背景に基づき、今回我々は、FRαリガンド(pteroyl基)、アルブミンリガンド(iodophenyl基)、ホウ素源(dodecaborate)が連結されたpteroyl-closo-dodecaborate-conjugated 4-(p-iodophenyl)butyric acid(PBC-IP)を開発しました(図1)[3]。
 |
|
| 図1 | Pteroyl-closo-dodecaborate-conjugated 4-(p-iodophenyl)butyric acid(PBC-IP)の分子デザインと細胞内取り込みの概要 |
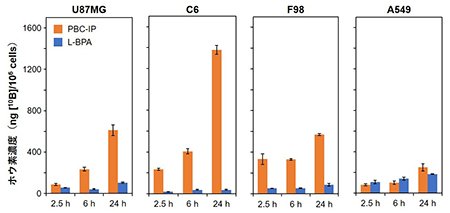
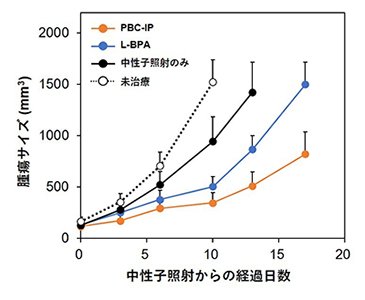
ELISA法によって測定されたPBC-IPのアルブミンに対する解離定数(Kd)は1.7 μMであり、BC-IPのKd(148.0 μM)よりも高い親和性を示したことから、pteroyl基がアルブミンとの相互作用に寄与することが示唆されました。U87MG(ヒトグリオブラストーマ由来)、C6(ラットグリオーマ由来)、F98(ラットグリオーマ由来)、などのヒトおよびラット脳腫瘍由来細胞へのPBC-IPの取り込み能を評価したところ、L-BPAよりも10~20倍多くのホウ素が取り込まれることが判明しました(図2)。一方で、ヒト肺がん由来A549細胞に対するPBC-IPとL-BPAのホウ素取り込み量はほぼ同等であったことから、PBC-IPは脳腫瘍細胞に特に集積しやすいことがわかりました。そこで、U87MG細胞の皮下異種移植マウスモデルにPBC-IPを尾静脈投与し、中性子照射を行ったところ、顕著な腫瘍増殖抑制効果が得られ、同用量のL-BPAを投与した群よりも有意に腫瘍増殖を抑制しました(図3)。
 |
|
| 図2 |
PBC-IPおよびL-BPAの曝露後2.5、6、24時間における各細胞のホウ素取り込み量
|
 |
|
| 図3 |
PBC-IPを投与したU87MG担がんマウスに中性子照射を行った後の腫瘍増殖曲線
|
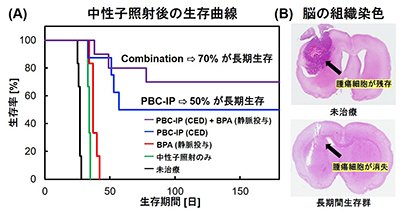
さらに、グリオーマラットモデルを用いて、convection-enhanced delivery(CED)法によってPBC-IPを脳内患部に局所投与し、中性子照射実験を行いました。L-BPA投与群は、生存期間中央値が37日であったのに対し、PBC-IP投与群の生存期間の延長効果は極めて高く、180日が経過しても全体の50%が生存しました(図4A)。さらに、PBC-IPとL-BPAを併用した群では、180日経過後も全体の70%が生存しました。長期間生存したラットの脳を組織染色し観察したところ、腫瘍細胞が残存していませんでした(図4B)。
 |
|
| 図4 |
(A)ラットグリオーマモデルにPBC-IPをCED法で投与し中性子照射を行った後の生存曲線(B)長期生存したラットと未治療ラットの脳組織染色画像
|
以上、本研究で開発したPBC-IPを用いたBNCTは、ヒトグリオブラストーマ皮下移植マウスモデルにおいて、高い腫瘍成長抑制効果を示しました。さらに、CED法を用いた脳内局所投与によって、通常のホウ素薬剤投与量の1/50の投与量でラットグリオーマ同所モデルの70%において腫瘍が消失するといった、極めて高い治療効果を発揮しました。グリオーマの中で特に悪性度の高いグリオブラストーマは、発見からの5年生存率が10%以下と、全てのがんの中でも予後が悪い難治性がんとして知られています。外科療法、化学療法、放射線療法はどれもグリオブラストーマに対する有効性が低く、有効な治療法はまだ確立されていませんが、本研究は、現行療法では困難なグリオブラストーマの治療に新たな可能性を示した点において、大きなインパクトをもたらすことが期待されます。
| [1] | F. Nakagawa, H. Kawashima, T. Morita, H. Nakamura, Cells 2020, 9, 1615. |
| [2] | K. Nishimura, S. Harrison, K. Kawai, T. Morita, K. Miura, S. Okada, H. Nakamura, Bioorg. Med. Chem. Lett. 2022, 72, 128869. |
| [3] | K. Nishimura, H. Kashiwagi, T. Morita, Y. Fukuo, S. Okada, K. Miura, Y. Matsumoto, Y. Sugawara, T. Enomoto, M. Suzuki, et al., J. Control. Release 2023, 360, 249-259. |
- 東工大ニュース(2023年7月11日)https://www.titech.ac.jp/news/2023/067150
- 日刊工業新聞(2023年7月17日)



