最新の研究
- 2024.06.03
- 北口研究室
酵素スイッチの創出を目指した耐熱性β-グルクロニダーゼの多量体化制御
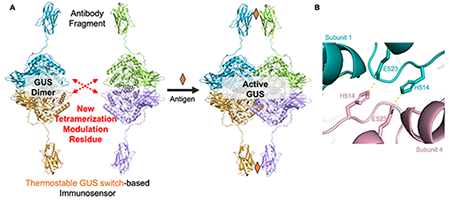
免疫測定は試料中の微量物質を検出・定量する手段として学術研究だけでなく臨床診断や食品安全管理、環境モニタリングにおいて広く利用されている。中でも洗浄操作を必要としないホモジニアス免疫測定法は"その場検出"に適しており、より簡便かつ高感度に目的物質を検出できる方法として、盛んに研究開発が行われている。こうした背景のもと、我々はホモ四量体のβ-グルクロニダーゼ(GUS)を利用した酵素スイッチOpenGUSの開発に取り組み、この酵素スイッチをホモジニアス免疫測定法へ応用する研究を行ってきた[1]。今回紹介するOpenGUSを利用した免疫測定法では、GUSに抗体の抗原認識ドメインが融合されている。抗原結合によってこの抗原認識ドメインが会合するのに伴って四量体GUSが形成され、酵素活性が上昇することで目的物質を検出する。ちなみに、OpenGUSの"Open"は通常は自発的に四量体を形成するGUSに変異を導入し、活性を持たない2つの二量体に開くことで分離してスイッチにした、ことから名付けている。ここでは、GUSのX線構造をもとにして相互作用界面を解析し、その情報を超耐熱性変異体GUS TR3に導入したライブラリ作製とスクリーニングによって、45℃の条件で酵素活性を持つ安定性が高い変異体GUSTR3-DLW(図1A)の開発ついて紹介する[2]。
酵素スイッチOpenGUSを利用した免疫測定法は、混ぜるだけで簡単に目的物質を検出できるホモジニアス免疫測定法である。しかしながら、開発初期のOpenGUSはタンパク質調製や保存による劣化が激しく、安定性に課題があった。そこで我々は、より実用的なOpenGUSの開発を目指して、GUSの超耐熱性変異体として報告があったGUSTR3を用いることで、安定性の向上に取り組むことにした。まず、GUSTR3にスイッチ機能を持たせるために、四量体界面への変異導入を行った。OpenGUS作製で重要なのは、通常の状態では酵素活性が失われるようにGUSの四量体界面に適切な変異を導入することである。しかし、開発初期のGUSで有効であった界面変異M516K/Y517E、M516K/Y517Wの導入ではどちらもGUSTR3において酵素活性を失わず、スイッチ機能を生じさせることができなかった。これは耐熱性変異の導入によりフォールディングと四量体化が強固になったため、M516とY517への変異導入だけでは、酵素活性のない二量体へ分離されなかったためと推測している。
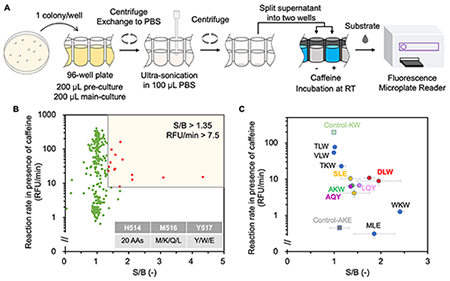
そこで、M516とY517以外のアミノ酸残基で四量体化に寄与している新たな相互作用を探し当てるため、GUSのX線構造を観察したところ、対角線上のアミノ酸(H514とE523)において塩橋が形成されている可能性が高いことを見出した(図1B)。そこで、M516とY517に加えてH514の3つのアミノ酸残基にさまざまな変異を導入したライブラリーを作製し、二量体になるために最適な変異を探索した。カフェインを認識する抗体断片をGUSTR3に融合し、カフェイン有り無しで、シグナルバックグラウンド比と反応速度を指標としてスクリーニングしたところ、H514D/M516L/Y517WのDLW変異体が、機能的でより耐熱性の高いOpenGUS となることを突き止めた(図2)。
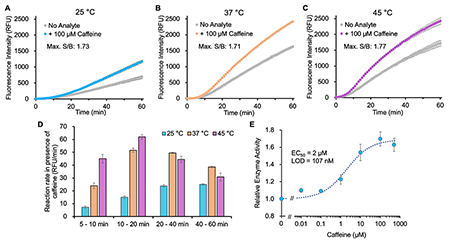
このように、四量体形成に重要な新たなアミノ酸を同定したことで、さらにスイッチ機能が高いOpenGUSへ展開できるようになった。また、開発初期のOpenGUSでは25℃より温度を上昇させると酵素活性が減少したのに対し、獲得した変異体GUSTR3-DLWは45℃で反応速度が4倍と上昇していた(図3)。熱安定性が高いタンパク質は保存性が向上していることが多く、Point-of-Care Testingなどで活躍することが期待できる。最近では、抗体結合タンパク質をOpenGUSに融合し[3]、ラベルフリー全長抗体で抗原を検出することができるONEPot Immunoassay Kit <OpenGUS Method>を開発している。この免疫測定構築キットは市販抗体を利用するため、抗体を取り換えることにより多様な抗原を検出でき、ELISAに代わる新たな免疫測定法として発展させることができると考えている。
| [1] | Su, J., Beh, C., Ohmuro-Matsuyama, Y., Kitaguchi, T., Hoon, S. and Ueda, H. (2019). Creation of stable and strictly regulated enzyme switch for signal-on immunodetection of various small antigens. J. Biosci. Bioeng., 128, 677-682. |
| [2] | Zhu, B., Qian, C., Tang, H., Kitaguchi, T. and Ueda, H. (2023) Creating a thermostable β-glucuronidase switch for homogeneous immunoassay by disruption of conserved salt bridges at diagonal interfaces. Biochemistry, 62, 309-317. |
| [3] | Zhu, B., Yamasaki, Y., Yasuda, T., Qian, C., Qiu, Z., Ueda, H. and Kitaguchi, T. (2023) Customizable OpenGUS immunoassay: a homogeneous detection system using split β-glucuronidase and label-free antibody. Jxiv, September 26, 2023. DOI: https://doi.org/10.51094/jxiv.511 |