最新の研究
- 2024.10.01
- 田中・吉田研究室
細菌のアミノ酸飢餓適応に関わるGTP合成の新たな制御機構
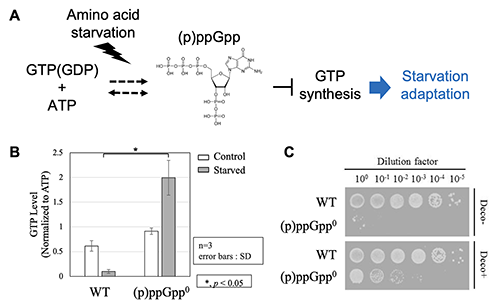
細胞には、生命活動を支える様々なエネルギー分子が存在します。その中で、グアノシン三リン酸(GTP)は、タンパク質合成や細胞分裂など、細胞の "動"的な生体プロセスの駆動に必要なエネルギー通貨として使われるエネルギー分子であり、「細胞の活動度」を決める役割を持っています。細菌における細胞内GTP量は、増殖フェーズに応じて大きく変化し、その量は細胞の倍加時間と相関することが分かっています。特にGTPの特性を表す細胞応答に栄養飢餓応答が挙げられます。細菌は栄養源が枯渇した環境に晒されると、増殖を停止させ、生存に必須な栄養源を合成します。この代謝切り替えには、GTP合成量を低下させることが重要であることが知られています1。このGTP合成量調節を担う機構として、「緊縮応答」が知られています。緊縮応答では、アミノ酸飢餓等のストレスに応じて、核酸小分子(p)ppGppがGTP(GDP)から合成されます。(p)ppGppはGTP生合成を直接阻害し、GTP合成量を低下させます。その結果、増殖が抑制される一方で、アミノ酸生合成に関わる遺伝子の発現が促進され、アミノ酸飢餓条件への適応を可能とします2,3 (図1A)。 (p)ppGppによるGTP合成量の調節が、アミノ酸飢餓条件への適応に必須であることは明らかとされていましたが、(p)ppGppの他にどういった因子がGTP合成量の調節に関わっているのかという点は、あまり理解されていません。
枯草菌において、(p)ppGppの合成を担う酵素遺伝子を全て欠損させた株[(p)ppGpp0株]は、アミノ酸飢餓条件で生育阻害を示します。野生株では、アミノ酸飢餓が誘導されると、GTP量が低下するのに対し、(p)ppGpp0株ではGTP量は増加します(図1B)。(p)ppGpp0株のアミノ酸飢餓培地条件における生育阻害は、GTP合成経路の酵素の阻害剤や遺伝子変異によって相補されます(図1C)。以上のことは、GTP合成を抑制できないことが、(p)ppGpp0株がアミノ酸飢餓条件で生育阻害を示す要因であることを示唆しています。私たちは、この (p)ppGpp0株を用いた遺伝学的解析を行うことで、アミノ酸飢餓条件への必須性を担うGTP合成量の調節に関わる新たな因子を見つけることができるのではないかと考えました。今回、私たちはこの(p)ppGpp0株を用いた解析から、メチオニン代謝がアミノ酸飢餓への適応に必須なGTP合成量の調節に関与していることを新たに見出しました4。
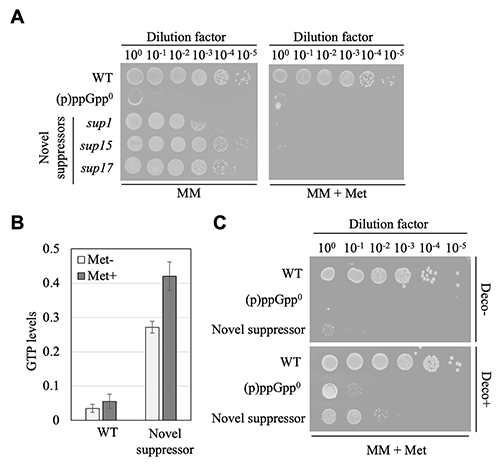
私たちはまず、(p)ppGpp0株からアミノ酸飢餓培地条件で生育が可能となる抑圧変異株をスクリーニングしました。過去の研究で、同様の抑圧変異株のスクリーニングが行われており、その結果、GTP合成経路の酵素遺伝子の変異が、抑圧変異株が生育回復する原因変異として同定されていました5。一方で、私たちが行ったスクリーニングでは、過去のスクリーニングで取得されたGTP合成経路の酵素遺伝子に変異を持つ抑圧変異株に加え、興味深いことに、GTP合成経路に直接関与しない遺伝子変異を持つ抑圧変異株も取得されました。このGTP合成経路に変異を持たない "新規抑圧変異株" について、より詳細な解析を進めた結果、新規抑圧変異株は、アミノ酸飢餓培地条件にメチオニンを添加すると、再び生育阻害を示すことを見出しました(図2A)。一方で、GTP生合成経路の酵素遺伝子に変異を持つ抑圧変異株では、メチオニン添加による生育阻害効果が見られないことから、新規抑圧変異株では、メチオニンが何らかの形でGTP合成を促進し、生育阻害を引き起こしているのではないかと考えました。この予想通り、新規抑圧変異株では、メチオニン添加によって細胞内GTP量が顕著に増加していることが明らかとなりました(図2B)。またメチオニン添加による生育阻害は、GTP合成経路の酵素の阻害剤の添加によって相補されました(図2C)。以上の結果から、アミノ酸飢餓培地条件において、新規抑圧変異株ではメチオニン添加でGTP合成が促進される結果、再び生育阻害を示すことが示唆されました。
 |
||
| 図2 | (A) | アミノ酸飢餓培地 (MM) における生菌率。MM+Met:メチオニン添加条件。 |
| (B) | アミノ酸飢餓培地条件におけるWT及び新規抑圧変異株の細胞内GTP量(HPLC解析)。 | |
| (C) | メチオニン添加による新規抑圧変異株の生育阻害効果に対するGTP合成酵素の阻害剤(Decoyinine)添加の影響。 | |
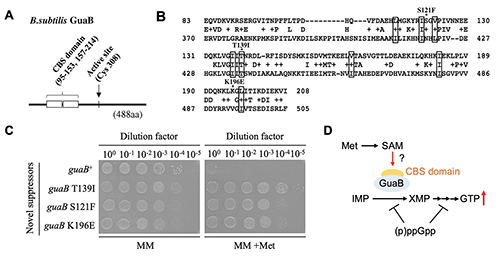
続いて私たちは、メチオニンがGTP合成を促進させるメカニズムを探ることにしました。メチオニンがGTP合成経路のどの段階から促進させる効果を持つかを遺伝学的に解析した結果、メチオニンの効果は、IMPからGTP生合成経路の初発反応を担う酵素IMPデヒドロゲナーゼ(GuaB)を起点に起きている可能性を見出しました。そこで私たちはGuaBにメチオニンまたはメチオニンの代謝産物が結合することで、その活性を正に制御しているモデルを考えました。GuaBには、CBSドメインと呼ばれるサブドメインが保存されており、グアニン・アデニンヌクレオチドがリガンドとして結合することが知られています(図3A)。また、CBSドメインはGuaB以外の酵素にも、主にアデニン骨格を持つ化合物が結合するドメインとして存在しています。メチオニンからはATPのアデニン骨格が付与されることで、S-アデノシルメチオニン(SAM)が合成されます。このSAMがCBSドメインのリガンドとして結合する酵素が幾つか存在しています。アーキアの持つ酵素でCBSドメインにSAMが結合した結晶構造が解かれており、そこで同定されていたSAMの結合に関与するアミノ酸残基は、枯草菌GuaBのCBSドメインにもほぼ同じ形で保存されていることに私たちは着目しました(図3B)。これらのアミノ酸残基の近傍に位置するアミノ酸残基の変異を新規抑圧変異株に導入したところ、メチオニンによる生育阻害が起きなくなりました(図3C)。以上の結果から、メチオニンから合成されるSAMがCBSドメインを介してGuaBを活性化し、GTP合成を促進する可能性が示唆されました(図3D)。
メチオニンはタンパク質合成に特に重要なアミノ酸として知られています。その代謝産物であるSAMも、種々の生体分子のメチル化修飾におけるメチル基の主要な供与体としての役割を持つ重要な代謝産物です。今回の私たちの研究から、こうした生命に重要な生体反応を支えるメチオニン代謝が、GTP生合成を直接制御していることが初めて明らかとなりました。
GTP合成の制御は、細菌の増殖制御に限らず、哺乳類のがん細胞において、増殖が亢進する要因にも深く関係していることが、明らかになってきています6。すなわち、GTP合成の制御は、生物普遍的に増殖の制御に重要な役割を担っていると考えられます。これまでGTP合成の制御機構は、今回紹介した細菌における(p)ppGppによる制御や、GTPによる律速段階の酵素に対するフィードバック制御が明らかになっている一方で、その他にどういった因子が関わっているのかという点は、どの生物でもあまり理解されていません。今後は、細菌からヒトに至るまで、GTP合成が細胞の増殖状態に応じてどういった因子に制御されているかを明らかにすることが課題であると考えられます。その先では、生物の細胞が増殖を制御するシステムの共通ルールや、生物進化の過程での多様化プロセスの理解に繋がると私たちは考えています。
【引用文献】
| [1] | Lopez., Arch Microbiol., 131(3):247-51 (1982) |
| [2] | Krásný & Gourse, EMBO J., 23(22):4473-83 (2004) |
| [3] | Krásný et al., Mol. Microbiol., 69(1):42-54 (2008) |
| [4] | Osaka et al., Mol. Microbiol., 113(6):1155-1169 (2020) |
| [5] | Kriel et al., Mol. Cell, 48, 231-241 (2012) |
| [6] | Kofuji et al., Nat. Cell Biol., (8):1003-1014 (2019) |