最新の研究
- 2024.12.16
- 西山・三浦研究室
がん表面に高密度で発現するアミノ酸トランスポーターを認識する新規ポリマーの開発
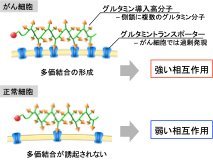
がん細胞は正常細胞と比べて増殖速度が速く、それを維持するためグルタミンを初めとするアミノ酸代謝が亢進している。この亢進したアミノ酸代謝を維持するため、がん細胞はASCT2(Alanine-serine-cysteine transporter 2)やLAT1(L 型アミノ酸トランスポーター1)を代表とするアミノ酸トランスポーターを過剰発現しており、正常細胞に比べてグルタミンを含むアミノ酸を多量に取り込んでいる[1]。このがんのグルタミン代謝を利用した診断・治療法の開発は非常に有効なアプローチであると考えられ、グルタミンはがんへの薬物送達における標的指向性分子として大きな可能性を秘めている。しかしながらグルタミンとトランスポーターとの結合力 (Kd = 20 µM) は既存の標的指向性分子 (Kd = ~10 nM) に比べて非常に弱く、グルタミン単体のままで標的指向性分子として展開するのは困難である[1][2]。そこで我々は複数のグルタミン分子とグルタミントランスポーターの多価結合による結合力向上に着目した。複数のグルタミン分子を高分子鎖に導入することで、グルタミントランスポーターが高密度で発現しているがん細胞表面とは強く相互作用し、一方グルタミントランスポーター密度が低い正常細胞とは多価結合による相互作用を示さないことで、がん細胞のみと選択的に相互作用する標的指向性分子になると着想した(Figure 1)。そこで上記のコンセプトを実証および生体内環境においてがんを標的化できる新規リガンド高分子としての応用を目指し、複数のグルタミン(Gln)分子を生体適合性が高いポリリシン(PLys)側鎖に導入したPLys(Gln)の創成(Figure 2a)と機能評価を行った[3][4]。
 |
|
| Figure 1. | グルタミン導入高分子と細胞との相互作用の模式図 |
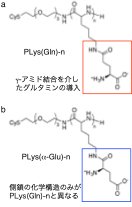
PLys(Gln)-n (n:重合度)は、NCA開環重合により合成したポリリシンの側鎖へGlnを縮合反応により導入して構築した。この際、 Gln分子のg位のアミド基の変換はASCT2とGlnの相互作用に影響を及ぼさないと考えられるため[4]、Glnのg位を結合部位とした利用した。コントロールの高分子として、PLys側鎖にグルタミン酸のa位を修飾させたPLys(a-Glu)-nを同様の手法で合成した(Figure 2 b)。PLys(a-Glu)-nは、電荷や分子量がPLys(Gln)-nと等しいが、側鎖のアミノ基の位置のみが異なる。合成した高分子と細胞との相互作用は、Cy5で標識した高分子の細胞内取り込みをflow cytometryにより定量することで評価した。
 |
|
| Figure 2. | (a)ポリリシン-グルタミンと(b)ポリリシン-aグルタミルの化学構造 |
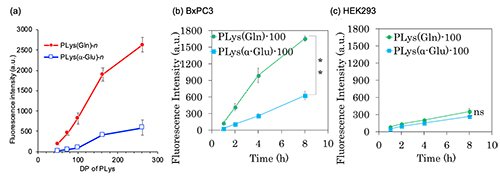
細胞種はASCT2が過剰発現しているA549細胞(ヒト肺がん細胞)を用いた。その結果、PLys(Gln)-nは重合度依存的な取り込み挙動を示し、PLys(Gln)-262の細胞内取り込み量はPLys(Gln)-50およびPLys(Gln)-75に比べそれぞれ12倍、5.5倍高かった(Figure 3a)。この重合度依存的な取り込みの向上はPLys(Gln)-nとがん細胞表面のトランスポーターとの多価結合によるものと示唆される。PLys(a-Glu)-nもわずかに重合度依存的な取り込みの増加が示されたが、その取り込み量はPLys(Gln)-nと比較して、5分の1程度であり、ポリマー側鎖上のGln構造をがん細胞が認識していることが示された。
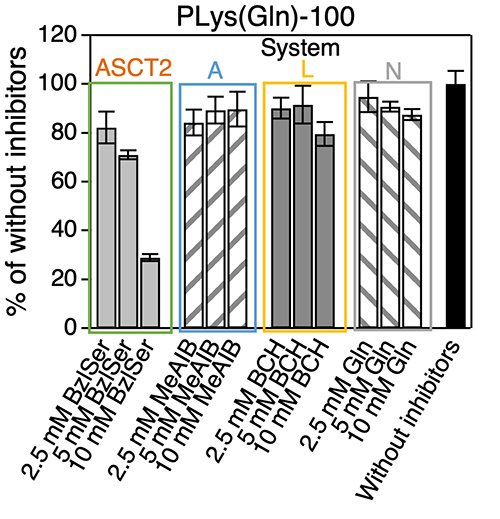
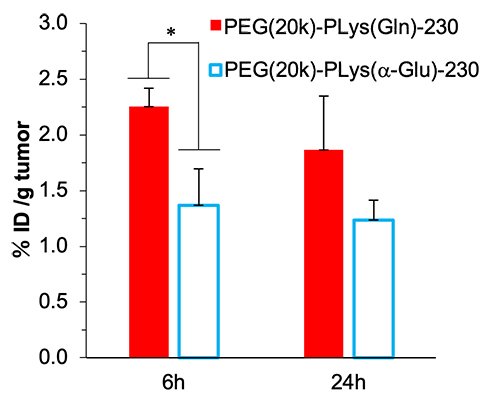
次に、ASCT2が過剰発現しているBxPC3細胞(ヒト膵臓がん細胞)と発現量が低いHEK293細胞(ヒト胎児腎細胞)を用いてPLys(Gln)-100の細胞内取り込みを経時的に測定したところ、BxPC3細胞ではHEK293細胞と比べ迅速に取り込まれ、8時間インキュベーション後における取り込み量は5倍も高かった(Figure 3 b, c)。また、PLys(Gln)-100とコントロールの高分子であるPLys(a-Glu)-100との比較では、HEK293細胞においては双方とも同様の取り込み挙動を示した一方で、BxPC3細胞においてはPLys(Gln)-100の方が迅速な取り込み挙動を示した(Figure 3b, c)。実際に、種々のグルタミントランスポーター(ASCT2, System A, L, N)阻害剤を共存させ高分子のBxPC3細胞内への取り込みを評価したところ、ASCT2阻害剤共存時のみ、PLys(Gln) -100の細胞内取り込みが抑制された(Figure 4)。これより、このグルタミン導入高分子がASCT2を認識して、取り込まれていることが確認された。これらの結果より、PLys(Gln)-100は高密度に発現しているASCT2を認識して、がん細胞に取り込まれることが示唆された。最後に、このグルタミン導入高分子の有効性をin vivo環境において確認するため、分子量20000のPEGを上述の高分子に導入したPEG-PLys(Gln)-230とPEG-PLys(a-Glu)-230を合成し、静脈内投与したところ、PEG-PLys(Gln)-230はPEG-PLys(a-Glu)-230と比較して高い腫瘍集積性を示した(Figure 5)。以上の結果から、グルタミンを高分子側鎖に複数導入し、腫瘍を強力に認識するアプローチは、がんの代謝異常を標的としたがん治療・診断技術の開発において有用なプラットフォームになり得ると考えられる。
 |
|
| Figure 3. | (a) A549細胞におけるPLys(Gln)-n(n=50,75, 100, 162, 250)の細胞内取り込み (b, c)BxPC3細胞およびHEK293細胞におけるPLys(Gln)-100、PLys(a-Glu)-100の細胞内取り込みの経時変化 |
 |
|
| Figure 4. | (a) A549細胞におけるPLys(Gln)-n(n=50,75, 100, 162, 250)の細胞内取り込み (b, c)BxPC3細胞およびHEK293細胞におけるPLys(Gln)-100、PLys(a-Glu)-100の細胞内取り込みの経時変化 |
 |
|
| Figure 5. | (a) A549細胞におけるPLys(Gln)-n(n=50,75, 100, 162, 250)の細胞内取り込み (b, c)BxPC3細胞およびHEK293細胞におけるPLys(Gln)-100、PLys(a-Glu)-100の細胞内取り込みの経時変化 |
さらに本コンセプトをベースに、癌で過剰発現している他のアミノ酸トランスポーターであるL 型アミノ酸トランスポーター1 (LAT1)を標的とした薬物送達システム(DDS)の構築も行った。LAT1はフェニルアラニンなどの芳香族アミノ酸を認識して、取り込むアミノ酸トランスポーターであり、ナノ粒子の表面や高分子の側鎖に担持させたものなどが近年報告されている[5]。これら芳香族アミノ酸に加えて、含硫アミノ酸のメチオニン(Met)も LAT1の基質分子であり、その構造はLAT1 標的リガンドとして利用できることが期待されるものの、Met様構造を導入した DDS の開発はほとんど行われていなかった。そこで、Metを高分子側鎖に修飾したMet修飾型高分子を構築し、機能を評価したところ、LAT1に対して選択性を有し、in vivoにおいても腫瘍に迅速かつ選択的に集積できることが示された[6]。
この様に、アミノ酸分子を高分子側鎖に複数導入する戦略は癌標的指向性分子DDS開発において有用なアプローチであり、さらなる展開が期待される。
参考文献:
| [1] | Jin, L., Alesi, G. N. & Kang, S. Oncogene,35, 3619-25 (2016). |
| [2] | Srinivasarao M., Galliford CV.1 & Low PS., Nature Rev., 14, 203-219(2015). |
| [3] | Yamada N., Honda Y. & Nishiyama N., et al., Sci. Rep. 7,.6077(2017). |
| [4] | Honda Y. & Nishiyama N., et al., ACS Appl. Bio Mater. , 4, 10, 7402-7407 (2021). |
| [5] | Nomoto T. & Nishiyama N., et al., Sci. Adv. 6 (4) eaaz1722 (2020). |
| [4] | Guo H., Nomoto T. & Nishiyama N., et al., Biomaterials 293, 121987 (2023). |



