最新の研究
- 2025.04.18
- 中村・岡田研究室
酸化鉄ナノ粒子とハイドロゲルを用いた磁場応答型薬物徐放システムと磁性ケージドカルシウムの開発
近年、磁場に応答し生体深部で薬物放出を誘導する機能性材料が開発されています。磁場応答性の薬物放出システムでは、交流磁場(AMF)に応答し局所的な熱を発生させる磁性ナノ粒子が広く用いられています[1]。この熱により、磁性ナノ粒子周囲の温度応答性薬物キャリアから薬物の放出が誘導されます。また、磁場応答性材料は、受容体の活性化を介してシグナル伝達を制御する化学ツールとして応用できる可能性を秘めています。今回我々は、磁場による薬物放出システムと化学ツールの両方に応用可能な、AMF応答性材料を新たに開発しました。以下にその詳細を紹介します[2]。
本研究で設計したAMF応答性薬物放出システムは、高分子で覆われた酸化鉄ナノ粒子(PCIO)とpoly(N-isopropylacrylamide)(PNIPAM)ベースの薬物キャリアゲルから構成されています(図1a)。PCIOとキャリアゲルが分離しているため、キャリアゲルを化学ツール用ゲルに置き換えることが容易に可能です。
 |
|
| 図1 | (a) AMF応答性薬物放出システムの概要。(b) AMF照射時におけるPCIOとPM-546封入キャリアゲル懸濁液の温度変化。(c) AMF照射によるPM-546放出の誘導。 |
PCIOは、オレイン酸コーティングされた酸化鉄ナノ粒子をコアとして親水性モノマーを表面に重合させることで合成されました。透過型電子顕微鏡とフーリエ変換赤外分光法(FT-IR)によりポリマー層の存在が確認され、その全重量に対する割合は1.5%でした。さらに、薬物キャリアゲルとしてNIPAMとアクリル酸(AA)からP(NIPAM-co-AA)を乳化重合で合成し、温度応答性や薬物封入・放出特性を評価しました。P(NIPAM-co-AA)は生理的浸透圧下で37~45℃の間で可逆的な体積転移を示し、体温近傍で作動する薬物キャリアとして機能しました。また、中性低分子であるPM-546の封入効率が最も高く、温度上昇に伴って放出が促進されました。10分のAMF(16 mT、386 kHz)照射と5分の非照射を1サイクル(15分)とし、PCIOとPM-546を封入したゲルの懸濁液に12サイクル(3時間)繰り返したところ、液温が25°Cから39°Cまで上昇しました(図1b)。AMF照射を4サイクル(1時間)と12サイクル(3時間)繰り返した溶液中のPM-546を定量し、AMF非照射時と比較しました(図1c)。その結果、AMF照射時においてPM-546の放出が有意に促進することがわかり、AMF誘導型薬物放出システムとして機能することが示されました。
さらに、薬物キャリアゲルを別のゲルに置き換えることで、化学ツールとしての応用可能性を探りました。代表的な化学ツールであるケージドカルシウムは、紫外可視光の照射によりCa2+を放出し、細胞内Ca2+シグナル伝達の制御に用いられてきました[3]。一方、光の組織透過性の限界から組織深部への適応や、サブmM濃度で変動する細胞外Ca2+の制御が困難でした。そこで、PCIOと温度応答性Ca2+結合ゲルを組み合わせ、「磁性ケージドカルシウム」として用いることで、磁場照射でCa2+濃度をサブmMオーダーで制御することを試みました(図2a)。温度応答性Ca2+結合ゲルの合成にあたり、ポリカルボン酸が体積転移することで側鎖カルボキシ基の距離が変われば、Ca2+の結合力を制御できると考えました。そこで、PNIPAMをpoly(methacrylic acid)(PMAA)でコーティングしたPMAA-coated-PNIPAMゲルを沈殿重合で合成しました。
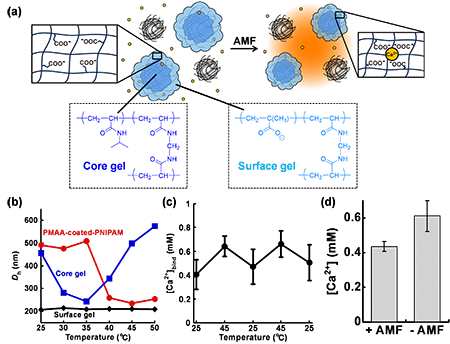 |
|
| 図2 | (a) 磁性ケージドカルシウムの概要。(b) 温度に対する各ゲルのサイズ変化。(c) 25℃および45℃の温度変化を繰り返した際のPMAA-coated-PNIPAMの可逆的なカルシウム吸着。(d) 磁性ケージドカルシウムとAMF照射による[Ca2+]の制御。 |
FT-IRスペクトルやゼータ電位の測定から、PMAA-coated-PNIPAMはPNIPAMとPMAA両者の特徴を持つことがわかりました。PMAA-coated-PNIPAMは温度依存的に体積が変化し、35℃以下では約500 nm、45℃では約235 nmとなりました(図2b)。また、PMAA-coated-PNIPAMは温度の上昇に伴いCa2+を吸着し、25〜45℃の範囲で可逆的なカルシウム吸着挙動を示しました(図2c)。PMAA-coated-PNIPAMの中和滴定曲線は温度によって変化しないため、PNIPAMが温度に応答し体積変化することで、PMAAゲルのカルボキシ側鎖の距離が変わり、Ca2+の結合力が変わることが示唆されました。PCIOとPMAA-coated-PNIPAMを組み合わせた磁性ケージドカルシウムにAMF(16 mT, 386 kHz)を1時間照射したところ、Ca2+濃度が0.18 ± 0.06 mM低下し、AMFによってCa2+濃度を制御できることが明らかになりました(図2d)。
以上、本研究ではPCIOとPNIPAMベースのハイドロゲルを用いて、AMFによって薬物放出やカルシウム濃度を制御する2つのシステムを開発しました。PCIOとPM-546を担持させたP(NIPAM-co-AA)を組み合わせると、AMF照射によりPM-546の放出が大幅に促進されました。将来的には、深部組織への埋め込み型薬物放出デバイスとしての応用が期待されます。また、PCIOと温度応答性Ca2+結合ゲル(PMAA-coated-PNIPAM)を組み合わせた磁性ケージドカルシウムにAMFを照射することで、Ca2+濃度を0.18 ± 0.06 mM減少させることに成功しました。本手法はさらなる最適化が必要ではあるものの、免疫応答ひいては腸内細菌との共生といった細胞外Ca2+が関わる生命機能を探るための化学ツールとしての応用が期待されます[4]。
参考文献:
| [1] | Gavilán, H.; Avugadda, S. K.; Fernández-Cabada, T.; Soni, N.; Cassani, M.; Mai, B. T.; Chantrell, R.; Pellegrino, T. Chem. Soc. Rev. 2021, 50, 11614-11667. |
| [2] | Okada, S.; Takashima, Y.; Nakamura, H. ACS Appl. Polym. Mater. 2025, DOI: 10.1021/acsapm.5c00652 |
| [3] | Ellis-Davies, G. C. R. Acc. Chem. Res. 2020, 53, 1593-1604. |
| [4] | Owen, J. L.; Cheng, S. X.; Ge, Y.; Sahay, B. Mohamadzadeh, M. Semin. Cell Dev. Biol. 2016, 49, 44-51. |



