最新の研究
- 2025.10.01
- 神谷・淺沼研究室
新たな色素母核に基づく蛍光プローブ/
ラマンプローブの開発
生体分子イメージング技術の発展に伴って、キサンテンやシアニンといった様々な色素を母核とした光機能性分子が開発されており、生命科学だけでなく臨床診断や蛍光ガイド手術といった治療でも応用されつつあります。このような背景の中、我々は最近、興味深い特性を有する色素母核に基づいた蛍光プローブやラマンプローブの開発に成功しましたので、2つの研究をご紹介します。
1つ目の研究はCoumarin-Hemicyanine(CHC)ハイブリッド色素を母核とした蛍光・ラマンプローブ開発です。
CHCは、Coumarin由来の短波長蛍光とCHC色素全体の長波長蛍光の比を使うことで定量的な蛍光イメージングを行うことができるratio型蛍光プローブとして知られています。我々のグループではこれまでに、CHC色素に分子内求核基を導入することで分子内環化によってそのratio蛍光を制御可能なCHCプローブの開発に成功してきました[1]。従来のCHC色素は650 nm程度の蛍光波長を有しますが、さらに長波長化した近赤外領域の蛍光は生体組織における透過性が向上し、組織深部のイメージングに有用であることが知られています[2]。また、近年注目を浴びているラマン顕微法ではこのように長波長な吸収特性を示す色素と近赤外波長の励起光によって強力に信号検出可能であることが報告されています[3]。
そこで本研究では、このCHC色素にニトリル基を導入することで長波長化した4CN-CHC色素を開発しました[4]。ニトリル基は適切な場所に導入することで様々な色素の長波長化に寄与することが知られているため、はじめにニトリルをCHC骨格の様々な置換位置に導入した誘導体を合成した(Fig. 1a)ところ、クマリン4位の置換位置に導入することで最も吸収波長を長波長化可能であることが明らかとなりました。また、開発した4CN-CHC色素はCHC色素と同様に、溶液のpHに応じた分子内環化反応によって吸収・蛍光特性をactivatableに変化させられることが確認されました(Fig. 1b)。
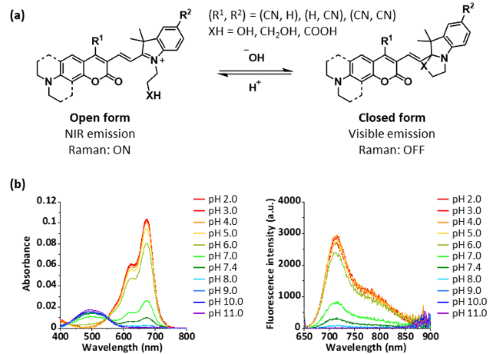 |
|
| Fig. 1 | | (a) ニトリル置換CHC色素の分子内環化平衡、(b) 4CN-JCHC-1のpH依存的な吸収・蛍光特性の変化 |
続いて、4CN-CHC色素の700 nmを超える近赤外蛍光の組織透過性について検討を行いました。色素の溶液に、生体の擬似組織としてトリのササミを積層した際の蛍光透過性を評価したところ、従来型のCHC色素が2枚以上の積層で大きく蛍光強度が減弱したのに対し、4CN-CHC色素は3枚の積層でも蛍光が十分検出され、より深部のイメージングに秀でていることが確認されました(Fig. 2a)。また、開発した4CN-CHC色素の1つである4CN-JCHC-1の蛍光ratio値が弱酸性域に変曲点を有することに着目し、酸性小胞であるlysosomeのpH変化を追跡する細胞イメージングを検討しました。LysosomeのpHを中性化することが知られているNH4Cl溶液の添加前後で蛍光画像を取得したところ、NH4Cl溶液添加に伴って開環体由来の長波長蛍光が顕著に減弱する様子が観察され、閉環体の短波長蛍光とのratio画像においてもNH4Cl溶液添加に伴うratio値の変化が可視化されました(Fig. 2b)。
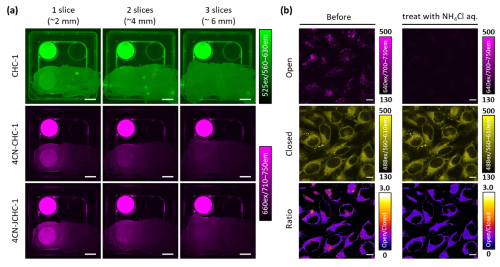 |
|
| Fig. 2 | | (a) 従来のCHC色素と4CN-CHC色素の蛍光組織透過性の比較、(b) 4CN-JCHC-1を用いたlysosomeのpH変化追跡 |
また、4CN-CHC色素のような長波長の吸収特性や三重結合のニトリル構造は分子振動を検出するラマンイメージングにも適していることが知られています[3]。特に、我々のグループではこれまでに、分子の吸収波長変化に伴ってラマン信号のoff/onを制御可能であることを見出している[5][6]ため、4CN-CHCの分子内環化による波長変化もラマン信号のoff/onに利用できるのではないかと考えました。実際に、4CN-CHC色素の開環体および閉環体のCARS(coherent anti-Stokes Raman scattering)スペクトルを取得したところ、閉環体では開環体と比べて信号強度が大きく低下することが確認され(Fig. 3a)、ニトリル基やC=C振動のラマン信号強度をpH依存的な分子内環化によって制御可能であることが示されました。さらに、蛍光スペクトルよりもピーク幅が狭く情報量に富むラマンスペクトルの特徴を活かし,蛍光検出では多重検出が難しい複数の4CN-CHC色素をCARSスペクトルで同時検出・イメージング可能であることが示されました(Fig. 3b)。
 |
|
| Fig. 3 | | (a) 4CN-CHC色素の分子内環化によるCARSスペクトル変化、(b) CARS顕微鏡による複数の4CN-CHC色素封入液滴の同時イメージング |
以上のように、本プローブは蛍光イメージングとラマンイメージングのいずれにも特徴的な性質を有しているactivatable型プローブであり、生体イメージングの可能性を切り拓くプローブとして期待されます。
この成果は、慶応義塾大学 加納英明教授、九州大学 平松光太郎教授および東京大学 浦野泰照教授との共同研究成果です。また、本研究の一部は東京科学大学のスーパーコンピュータTSUBAME4.0を利用して実施されました。
2つ目の研究としては、水溶液中で凝集性を有する色素BzBMNを母核とした新規酵素活性検出ラマンプローブの開発を紹介致します。
生体内で働く様々な酵素活性を検出する蛍光プローブは、生命科学研究から臨床研究まで幅広い分野で活用されています[7]。しかし蛍光プローブはその幅広い吸収・蛍光スペクトルの重なりが原因で、同時に可視化できる酵素の種類は4~5種類に限られるという課題がありました。一方でラマンイメージングではスペクトルの線幅が蛍光よりも狭いため、より多くの種類の分子を見分けて同時に検出できる手法として注目されています[3, 5-6]。我々は、色素の凝集体は局所濃度が高いため濃度が低い分散状態よりも強いラマン信号が観察されるという予備的知見に着目し、酵素との反応前後でプローブの凝集性が大幅に変化することで、酵素活性を検出する新たな動作原理に基づくラマンプローブの設計と開発を行いました(Fig.4)[8]。
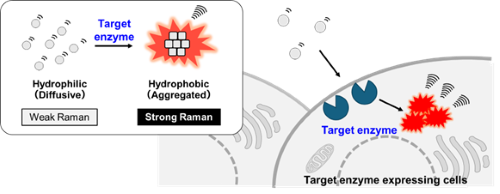 |
|
| Fig. 4 | | 凝集性制御に基づく酵素活性検出ラマンプローブの模式図 |
まず、水溶液中で凝集体を生じる色素母核としてBzBMNに着目しました[9]。BzBMNは合成が容易で構造展開が行いやすいこと、ラマンイメージングで細胞由来の信号が少ない波数領域に特徴的なラマン信号を示すニトリル基を有していこと、そして凝集すると蛍光特性が変化する凝集誘起発光増強(Aggregation-induced emission enhancement)特性を有しており、凝集体形成の評価が行いやすことから本研究におけるプローブの母核構造として適していると考えられました。
そこで、BzBMNに基質部位を導入するための足場としてアミノ基を導入したBzBMN-NH2を合成・評価したところ、水溶液中で凝集特性を有していることが明らかになりました。続いて、一部のがん細胞で発現が特異的に亢進していることが知られるγ-glutamyltranspeptidase(GGT)を標的としたプローブとしてBzBMN-NH2にγ-グルタミン酸を導入したgGlu-BzBMNを設計・合成しました(Fig. 5a)。gGlu-BzBMNはBzBMN-NH2と比較して水溶性が向上しており、ラマンイメージングでそれぞれの水溶液を観察したところ、gGlu-BzBMN溶液は凝集体をほとんど認めませんでしたが、GGTを添加したところBzBMN-NH2が生成して凝集体生成を認め、強いラマン信号が観察されました(Fig. 5b)。この反応は阻害剤添加によって抑制されたことからgGlu-BzBMNはGGT活性を検出可能なラマンプローブであることが明らかになりました。
同様に、基質部位をグルタミン酸-プロリンのジペプチドとしたプローブEP-BzBMNはジペプチジルペプチダーゼIV(DPP4)を、β-galactopyranosideとしたプローブβGal-BzBMNはβ-galatosidase活性を検出可能であり、さらにアゾホルミル基を介してBzBMNにグルタミン酸を導入したBzBMN-AF-Gluは前立腺がん細胞などで高発現していることが知られているグルタミン酸カルボキシペプチダーゼprostate specific membrane antigen(PSMA)の活性を検出可能であることが示されました(Fig. 5c, 5d)。このように、本プローブは様々な加水分解酵素を標的とすることができることが明らかになりました。
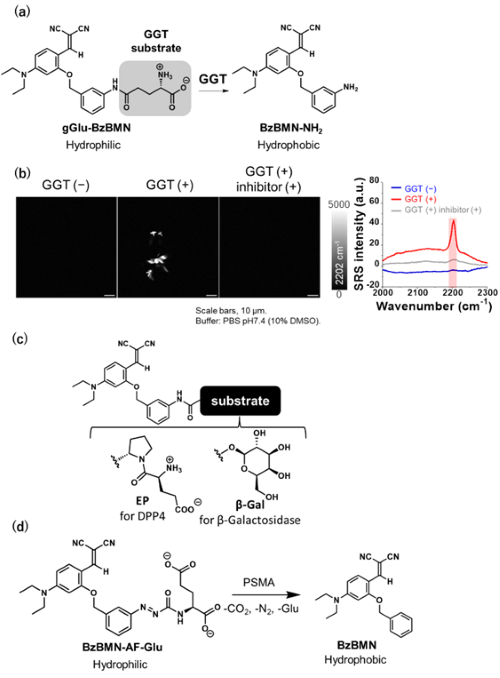 |
|
| Fig. 5 | | (a) gGlu-BzBMNの分子構造及びGGTとの反応式、(b) 誘導ラマン散乱(SRS)顕微鏡によるGGT活性のラマンイメージング及びラマンスペクトル、(c) DPP4及びβ-galactosidaseを標的としたラマンプローブの分子構造、(d) 前立腺がん特異的膜抗原(PSMA)を標的としたラマンプローブの分子構造及びPSMAとの反応式 |
続いて、gGlu-BzBMNをGGTが高発現しているA549肺がん細胞にアプライしてラマンイメージングで観察したところ、細胞内から強いラマン信号を有する輝点が観察されました。これらの輝点はGGTに対する阻害剤添加や、GGT低発現細胞であるH226肺がん細胞ではほとんど認めなかったことから、gGlu-BzBMNは細胞のGGT活性も検出可能なラマンプローブであることが明らかになりました。同様に、EP-BzBMNとβGal-BzBMNもそれぞれ生細胞における標的酵素活性を検出できることが確認されました。
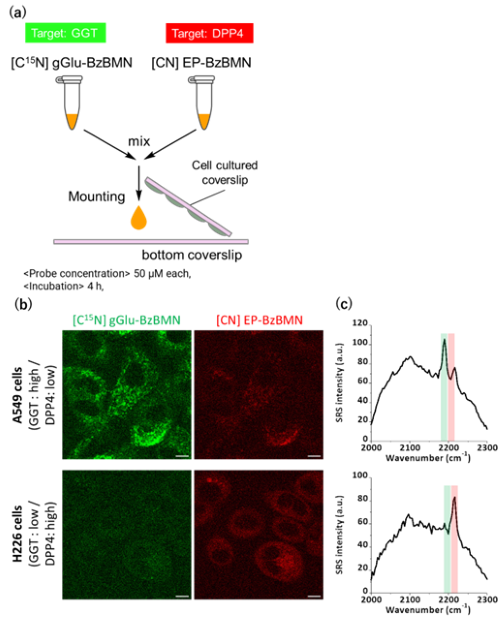
最後に複数酵素活性の同時多重イメージングを試みました。まず、ニトリル基を同位体置換した誘導体を開発し、ラマンスペクトルを測定したところ、同位体の種類によって波数が変化し、それぞれが区別可能なラマンシフト値を有していることがわかりました。そこで、ニトリル基をC15Nとした[C15N]gGlu-BzBMN(GGTプローブ)とEP-BzBMN(DPP4プローブ)を混ぜ合わせて、A549細胞またはH226細胞にアプライしてラマンイメージングを行ったところ、A549細胞からはC≡15N伸縮振動に由来するピーク(GGTプローブ)が、H226細胞からはC≡N伸縮振動に由来するピーク(DPP4プローブ)がそれぞれ強く検出され、それぞれの酵素活性のパターンを反映したラマン信号がイメージングで可視化できることが明らかになりました(Fig. 6)。
 |
|
| Fig. 6 | | (a) [C15N] gGlu-BzBMNとEP-BzBMNによるGGT・DPP4活性同時ラマンイメージング、(b) GGT活性(緑)及びDPP4活性(赤)のラマンイメージング及び (c) ラマンスペクトル。 |
本研究で開発されたラマンプローブは従来のラマンプローブと比較して安定性が高く、分子設計の柔軟性が高いため、さらに多様な種類の酵素活性を同時観察できるツールとして生命科学研究での応用が期待されます。
この成果は、東京大学 小関泰之教授および東京大学 浦野泰照教授との共同研究成果です。
| 参考文献 | |
| [1] | H. Fujioka, S. Uno, M. Kamiya, R. Kojima, K. Johnsson and Y. Urano, Chem. Coomun. 2020, 56 (42), 5617-5620. |
| [2] | H. Li, Y. Kim, H. Jung, J. Hyun and I. Shin, Chem. Soc. Rev. 2022, 51 (21), 8957-9008. |
| [3] | L. Wei, Z. Chen, L. Shi, R. Long, A. Anazalone, L. Zhang, F. Hu, R. Yuste, V. Cornish and W. Min, Nature, 2017, 544 (7651), 465-470. |
| [4] | H. Fujioka, R. Sakamoto, K. Hiramatsu, Y. Murakami, M. Masaki, M. Kawatani, S. Matsumoto, R. Kojima, Y. Urano, H. Kano and M. Kamiya, Anal. Chem. 2025, 97 (32), 17589-17597. |
| [5] | H. Fujioka, J. Shou, R. Kojima, Y. Urano, Y. Ozeki and M. Kmiya, J. Am. Chem. Soc. 2020, 142 (49), 20701-20707. |
| [6] | H. Fujioka, M. Kawatani, S. Spratt, A. Komazawa, Y. Misawa, J. Shou, T. Mizuguchi, H. Kosakamoto, R. Kojima, Y. Urano, F. Obata, Y. Ozeki and M. Kamiya J. Am. Chem. Soc. 2023, 145 (16), 8871-8881. |
| [7] | K. Fujita, Y. Urano, Chem Rev. 2024, 124 (7), 4021-4078. |
| [8] | M. Okinaka, M. Kawatani, H. Fujioka, S. J. Spratt, H. Ito, Y. Misawa, R. Otake, A. Ishikawa, R. Kojima, Y. Urano, Y. Ozeki and M. Kamiya, Anal. Chem. 2025, 97 (35), 19057-19065. |
| [9] | Q. Dai, W. Liu, L. Zeng, C. Lee, J. Wu, P. Wang, CrystEngComm. 2011, 13, 4617. |



