最新の研究
- 2014.02.27
精密合成高分子をプラットフォームとするナノメディシンの開発
我々が健康で豊かな生活を行う上で薬の存在は必要不可欠です。薬を開発するプロセスは創薬と呼ばれますが、現代医学における創薬は、ターゲットの探索、候補化合物のコンビナトリアル合成とスクリーニング、リード化合物の同定と最適化を経て、さらに実験動物による有効性・安全性試験、患者さんに対しての臨床試験において合格した化合物が新薬として実用化されます。このプロセスにおいて、候補化合物のうち臨床試験に進むことができるのは0.011%、新薬として承認されるのはわずか0.003%と言われており(製薬協データブック2011)、数千億円とも言われる莫大なコストと10年以上に及ぶ開発期間が必要となります。さらに、これまでに様々な化合物が開発され、従来と同様な創薬プロセスでは新規化合物を見出すことが益々困難になってきていると言われています。
一方、近年のバイオテクノロジーの急速な進歩によって、アプタマー、ペプチドおよび抗体といった標的化分子をはじめとするさまざまな機能性分子が開発され、それらの医薬品としての実用化が期待されています。また、材料科学、ナノテクノロジーを基盤として、環境・刺激に応答するスマート分子・材料の開発が盛んに行われています。これらの分子・材料も高付加価値な医薬品分野への応用が期待されています。しかしながら、これらの機能性分子は非常に大きなポテンシャルを秘めているものの、医薬品としての応用は必ずしも期待通りには進んでいないように思われます。
このような背景において、我々は、精密合成高分子をプラットフォームとする新しい薬の開発、すなわち「高分子創薬」に関する研究を行っています。薬の機能を高めるためには、薬とその効能を高める機能性分子を合体させることは極めて有効なアプローチであると考えられますが、直接的に結合してもお互いの機能が阻害され、さらに体内に投与した際の行き先が大きく変わってしまうために期待した効果はなかなか得られません。運動会の二人三脚では上手に走れないのと同じです。そこで高分子創薬の考え方では、合成高分子をプラットフォームとして薬や機能性分子を一分子中に創り込むことによって、薬に新たな機能を付加していきます。例えれば、合成高分子は、自動車のようなもので、沢山人が乗ってもちゃんと目的地まで到着することができますし、喧嘩することもありません。すなわち、合成高分子が、薬の機能を高め、最先端技術で生み出されたさまざまな機能性分子を融合させ実用化へと結びつけるための架け橋となるのです。高分子をスマートフォンに例えるなら、薬や機能性分子は搭載するアプリと考えることができ、その可能性は無限大です。
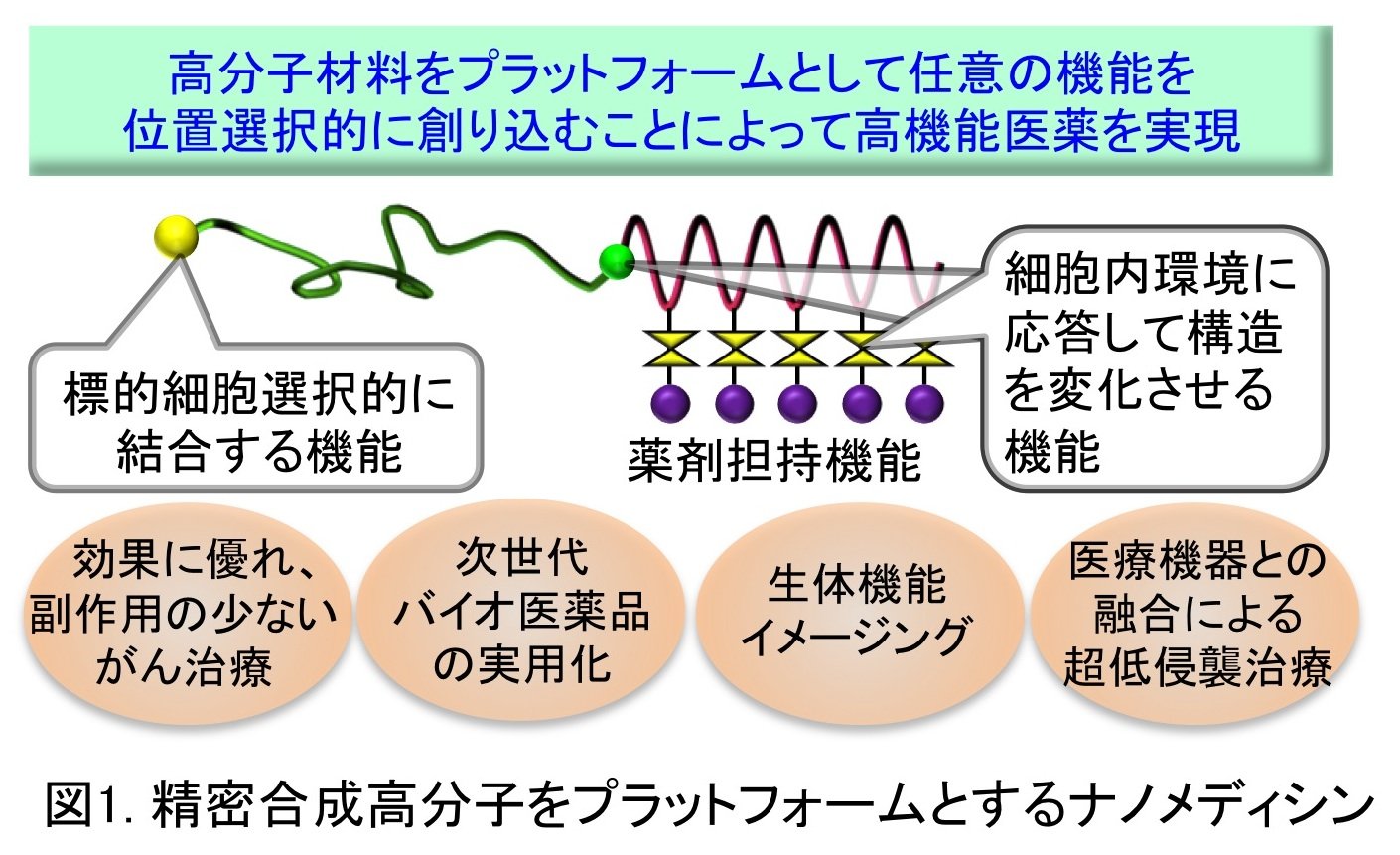
このような「高分子創薬」において基盤技術となるのが、高分子の一次構造を精密に制御し、位置選択的に官能基を導入するための精密高分子合成技術です。一般的には、このような高分子はリビング重合といわれる方法によって合成されます。このような精密合成高分子の医療応用は、我が国が世界をリードしてきた分野でもあります。資源化学研究所 高分子材料部門(西山研究室)では、精密合成高分子のプラットフォームに、薬剤担持機能、標的細胞選択的に結合する機能、細胞内環境に応答して構造を変化させる機能を創り込むことによって生体内で高度な機能を発現するナノ医薬品(ナノメディシン)を構築し、効果に優れ副作用の少ないがん治療、次世代バイオ医薬品(抗体、オリゴ核酸)の実用化、生体機能イメージング、医療機器との融合による超低侵襲治療などの最先端医療に展開していくことを目指しています(図1)。
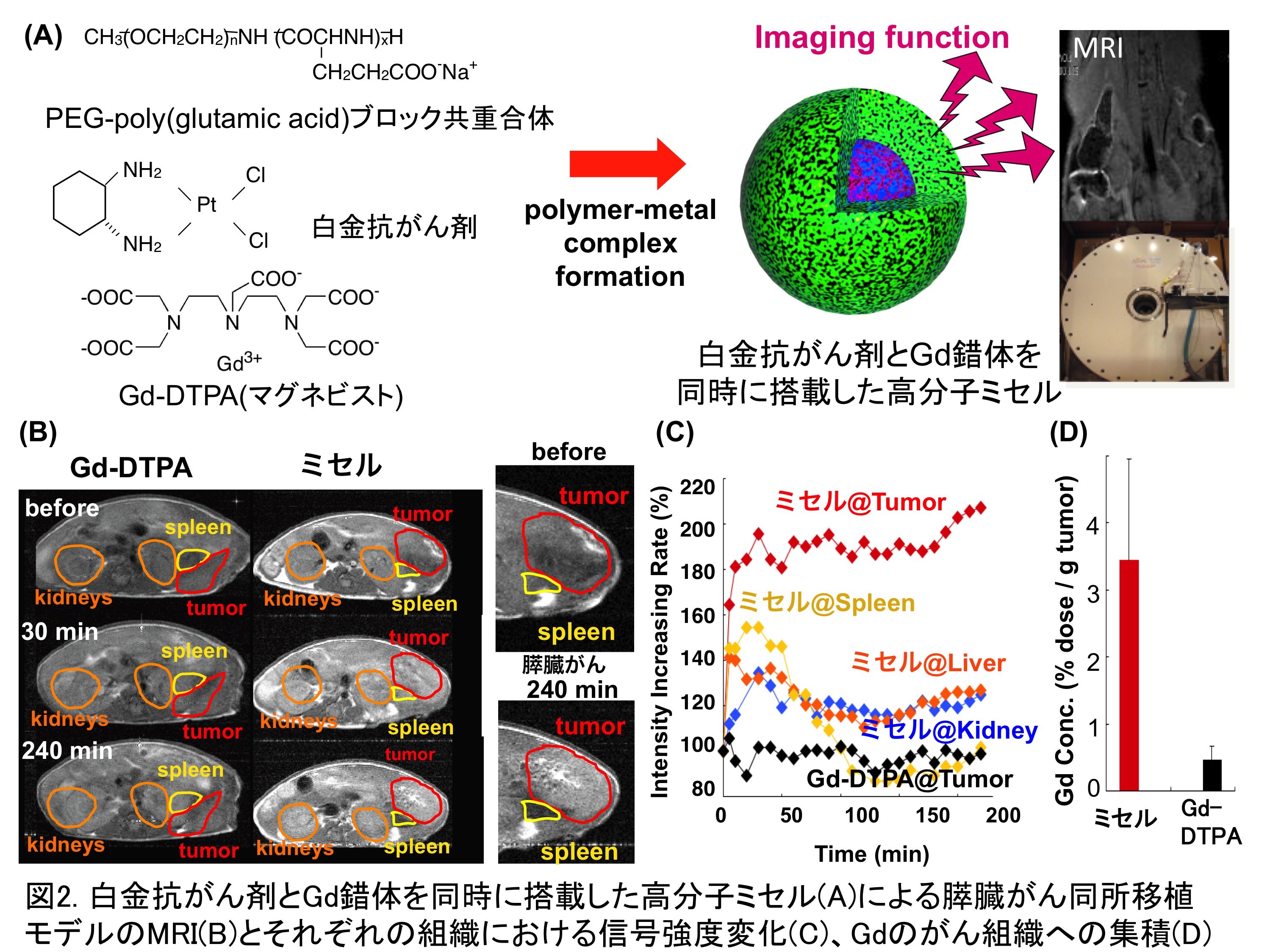
今回の最新の研究では、イメージング機能を搭載したナノメディシンに関する研究を紹介したいと思います。もし、薬を可視化できたら、薬が到達して欲しい患部や逆に薬が集積して欲しくない正常臓器・組織にどれくらい薬が集まったかを体外からリアルタイムで確認できるようになります。このイメージングによって得られた結果に基づいてレジメンを最適化すればより確実な治療が可能になると思われます。しかしながら、イメージングのためのプローブ分子を薬に直接結合すると薬の体内分布が大きく変化し、薬自体の活性が大きく損なわれてしまいます。これに対して、ナノメディシンでは、その体内分布はプラットフォームとなる高分子の特性と標的化分子によって決定され、プローブ分子の修飾による影響を受けません。従って、ナノメディシンではプローブ分子の導入による可視化が可能になります。そこで、我々は、精密高分子合成により得られるブロック共重合体の自己会合により形成されるコア-シェル型のナノ粒子、すなわち高分子ミセルに白金抗がん剤とMRI造影剤であるGd錯体を同時に搭載したナノメディシンを開発しました(図2A)。本システムでは、ミセル内核において、Gd錯体の分子運動が抑制され(回転相関時間(τR値)が増加)、Gdとプロトンの接触機会が増加することによって、臨床で使用されているGd錯体(マグネビスト)の24倍のT1緩和能を示すことが確認されています。この高分子ミセルをイメージングによる検知が極めて困難な膵臓がんの同所移植モデル(膵臓がん細胞を膵臓に移植したモデル)マウスに投与したところ、がん組織で選択的にMRI信号強度が増大することが確認されました(図2B、C)。一般的に、固形がんにおいては、血管の構造が幼若で物質の透過性が亢進しており、高分子物質が集積しやすい環境が形成されていることが知られていますが(Enhanced Permeability and Retention(EPR)効果)、本システムでも高分子ミセルはマグネビストと比較して7倍のGd錯体のがん集積量を示すことが確認されています(図2D)。さらに、本システムでは、白金抗がん剤による膵臓がんの治療効果をMRIによって追跡できることも明らかになりました。このような治療効果を追跡する機能を実際のがん治療に応用すれば、抗がん剤の迅速効果判定が可能になり、「手遅れのない」がん治療が実現できるものと我々は考えています。
1) P. Mi, H. Cabral, D. Kokuryo, M. Rafi, Y. Terada, I. Aoki, T. Saga, T. Ishii, N. Nishiyama, K. Kataoka, Gd-DTPA-loaded polymer-metal complex micelles with high relaxivity for MR cancer imaging. Biomaterials 34 (2) 492-500 (2013)
2) H. Cabral, N. Nishiyama, K. Kataoka, Supramolecular nanodevices: From design validation to theranostic nanomedicine. Acc. Chem. Res. 44 (10) 999-1008 (2011)
3) S. Kaida, H. Cabral, M. Kumagai, A. Kishimura, Y. Terada, M. Sekino, I. Aoki, N. Nishiyama, T. Tani, K. Kataoka, Visible drug delivery by supramolecular nanocarriers directing to single-platformed diagnosis and therapy of pancreatic tumor model. Cancer Res. 70 (18) 7031-7041 (2010)