最新の研究
- 2014.06.02
ホウ素による分子性超ルイス酸の開発
ホウ素化合物は、ヒドロホウ素化や鈴木−宮浦クロスカップリングなど多様な反応に利用され、有機合成において重要な役割を果たしています。ホウ素化合物の性質や反応性は、その電子不足性とホウ素の低い電気陰性度に特徴づけられます。最も典型的なホウ素化学種は中性三配位のボランと呼ばれる化合物です(図1)。この状態のホウ素は3つの結合をもち、ホウ素上には空の2p軌道があります。ボランは、この空の軌道を使って他の原子やイオンから電子対を受け取り、4つめの結合を作ることで安定化します。このようなボランの反応性は、オクテット則により説明できます。オクテット則とは、ある化学種が「構成する典型元素の価電子数が8つになるように反応する」という化学の基本原理で、特に第二周期元素に対して厳密に適用されます。ボランの場合、ホウ素の価電子数は6つであり、電子対を受け取り価電子が8つになることでオクテット則を満たすようになります。ボランは、強いルイス酸性(電子対を受け取りやすい性質)をもつ化合物の代表的な例です。
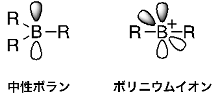
図1. 中性ボランとボリニウムイオンの構造.
ホウ素原子の上下のローブは、空の2p軌道を表す.
それでは、中性のボランからさらに結合の手を一本取り去ってしまった場合、どのようことが起こるのでしょう?ボランでさえ結合が足りないのです。そもそも、そのような化合物は安定に存在するのでしょうか?
このように結合の手が2つしかないホウ素化合物(この状態のホウ素の価電子はたった4つ!)は陽イオン(カチオン)の状態であり、「ボリニウムイオン」(図1)と呼ばれています。過去にいくつかのボリニウムイオンが報告されていますが1、それらの化合物では、ホウ素に結合している置換基が電子対を与え、なんとか安定に存在できるといったものでした。今回私たちの研究グループでは、これまで安定に存在し得ないと考えられてきた、電子をあげる能力がとても小さい芳香環のみが結合したボリニウムイオンを、世界で初めて合成することに成功し、さらにその異常に強いルイス酸性に基づく特異な反応性を明らかにしました2,3。
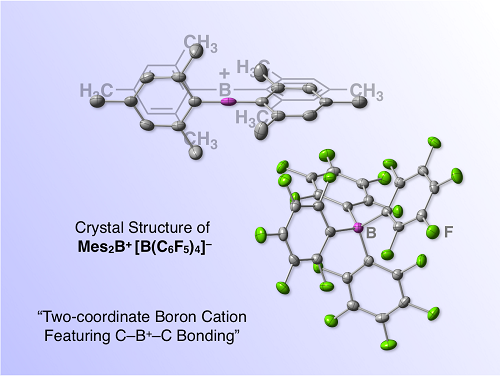
図2. ホウ素による分子性超ルイス酸「ボリニウムイオン」の塩の結晶構造. 配位のボリニウムイオンと四配位のボラートアニオンからなる興味深い分子構造を有している.
ボリニウムイオンの合成にあたっては、①ホウ素上の置換基として適度な立体障害をもつ芳香環であるメシチル基(2,4,6-トリメチルフェニル基)を用いること、および②対アニオンとして化学的に安定なアニオン種を用いるという戦略をとりました。その結果、意外にも簡便に高収率でボリニウムイオン塩を得ることができました。ボリニウムイオンの詳細な分子構造は、各種分光分析に加え、単結晶X線構造解析により明らかにしました(図2)。このボリニウムイオンは熱力学的に極めて安定で、例えば対アニオンとしてカルボランアニオンを有する塩の場合、結晶試料を300 ℃まで加熱しても分解しません。また、実験結果と理論化学計算の比較により、溶液でも固体状態でも、ボリニウムイオンのホウ素中心は対アニオンや溶媒の配位を受けていないことがわかりました。さらに、理論化学計算を行ったところ、ボリニウムイオンの最低非占有軌道のエネルギー準位は、既存のホウ素化合物のものと比較して著しく低い -5.41 eVと見積もられました。以上の結果は、ボリニウムイオンが熱力学的に安定でありつつも、同時に極めて高いルイス酸性を有していることを示しています。
このボリニウムイオンは高い反応性をもち、二酸化炭素という非常に安定な化合物に対しても異常な反応を引き起こします。ボリニウムイオン塩の溶液に二酸化炭素ガスを混合すると、二酸化炭素の炭素原子にボリニウムイオンのメシチル基が移り、かつ酸素を一つ失ったカチオン化合物が速やかに生成します(図3)。すなわち、二酸化炭素の安定なC=O二重結合が、ボリニウムイオンにより切断されてしまうことを意味しています。この反応は、強いルイス酸中心であるボリニウムイオンのホウ素原子に、二酸化炭素の酸素原子が配位することから進行すると考えられます。理論化学計算による考察では、この反応機構がエネルギー的に十分起こりうるものであることが示されました。二酸化炭素でさえも活性化してしまうボリニウムイオンは、様々な物質とユニークで有用な反応を起こし得る新しい化学種として期待できます。
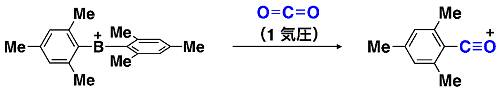
図3. ボリニウムイオンによる二酸化炭素の脱酸素化-アリール化反応.
参考文献
(1) "The chemistry of borinium and borenium ions"
P. Kölle, H. Nöth
Chem. Rev. 1985, 85, 399-418.
(2) "A two-coordinate boron cation featuring C-B+-C bonding"
Y. Shoji, N. Tanaka, K. Mikami, M. Uchiyama, T. Fukushima
Nature Chem. 2014, 6, 498-503.
(3) "Boron served straight up"(本成果のハイライト記事)
C. Reus, M. Wagner
Nature Chem. 2014, 6, 466-467.



