最新の研究
- 2014.07.31
光線力学療法のための新しい光増感性脂質の開発とリポソーム化
現在の一般的ながん治療は、外科療法,化学療法,放射線療法による複合治療によって,各々の患者さんに相応しい治療が施されています。その一方で、副作用を低減した低浸襲性でQOLの高いがん治療の開発が望まれており、その一つに光線力学的治療法(PDT)があります。PDTはポルフィリン化合物のような光感光剤に吸収波長の低エネルギーレーザーを照射することで、組織内の溶存酸素に対してエネルギー又は電子の享受が行われ、それによって産生する活性酸素(ROS)により、がん細胞を殺傷する治療法であります(図1)。現在、日本では代表的な光感光剤としてフォトフィリン、レザフェリンが上市されていますが、より腫瘍選択的で且つ長波長の吸収を有する新たな薬剤開発が求められています。近年、腫瘍組織は血管から微粒子が流出しやすく、さらに腫瘍組織に到達した微粒子はリンパ管回収機構が不完全なため蓄積するという特性を利用して、薬剤を腫瘍組織へ送達させる薬剤送達システム(DDS)が注目されています。
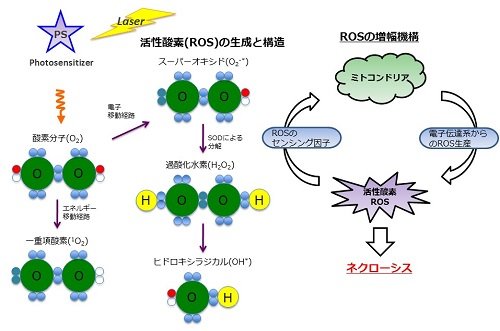
図1.光線力学療法(Photodynamic Therapy:PDT)の原理
そこで、我々は、DDSに用いられているナノキャリアである直径約100 nmのリポソームや不活化したセンダイウィルスの膜に挿入することが可能な、プロトポルフィリンIX (PPIX)の脂質化の合成開発に成功しました(図2)。このことにより、PPIX自体、難容性であり、腫瘍への選択性が不確かであることが問題点でありましたが、それを解決する突破口を開きました。

図2. ポルフィリン脂質(PL-C17)の構造とそのリポソーム形成
まず、我々は、PL-C17リポソームの調製を行いました。薬剤のリポソームへの封入法には図2に示しますように、PL-C17は、水溶液中ではミセルを形成していますが、ポストインサーション法によってリポソーム膜など生体膜へ修飾することができます。実際に、生理食塩水内封リポソームをリン脂質(DSPC)、コレステロール、そして分子量2,000のポリエチレングリコールが結合したリン脂質(DSPE-PEG2000)を1 : 1 : 0.11の比で混合し、逆相蒸発法を用いて粒子径が約100 nmのリポソームを調製しました。そこへ、PL-C17ミセルを混合することで、リポソームへのPL-C17挿入に成功しました。 このようにして、調製しましたPL-C17リポソームを用いて、がん細胞(HeLa細胞)内における局在を調べました。PL-C17それ自体が赤色の蛍光を持つことから、これら各薬剤を100 μMの濃度で3時間曝露し、PBSによる洗浄後の取り込みを共焦点顕微鏡で観察しました。PL-C17ミセルが細胞膜及び細胞質に局在しているのに対して、PL-C17リポソームは細胞質及びゴルジ体に局在しているのが観察されました。この理由としては、リポソームはエンドサイトーシスにより細胞内へ取り込まれ、排出に至るまでの代謝経路の一つとしてゴルジ体に局在したものと考えられます(図3)。
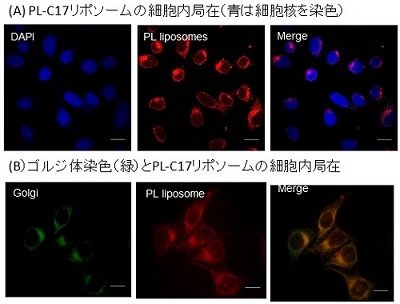
図3. PL-C17リポソームの細胞内局在
PL-C17リポソームのHeLa細胞に対するPDT効果を調べてみました。PL-C17リポソームを0.1-100 μM加えて3時間取り込ませた後、薬剤を取り除いた後、400-800 nmの波長のキセノンランプにて88 mW/cm2で2分間の照射を行い、72時間後にMTTアッセイ法により50 %阻害評価(IC50)を行いました。その結果、光未照射群と薬剤投与がないものに関しては、まったく細胞死が観察されなかったのに対して、PL-C17リポソームを暴露し光照射した細胞群では、50%細胞成長阻害濃度(IC50)は、12.9 μMという高いPDT効果が得られました。また、活性酸素検出試薬を用いて、光照射による細胞内活性酸素を測定しました。その結果、PL-C17リポソームの濃度依存的に細胞内で活性酸素が産生しており、このことが高いPDT殺細胞効果をもたらしていると考えています(図4)。 現在、大阪大学大学院工学研究科の粟津研究室ならびに同大学院医学研究科の金田研究室と、不活化したセンダイウィルスのエンベロープへのPL-C17挿入による免疫不活作用をもつ新しい光増感剤開発の共同研究を進めています。
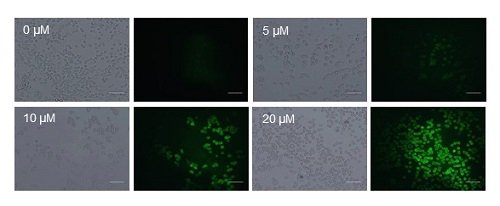
図4. PL-C17リポソームの光照射による細胞内活性酸素産生
参考文献
1) "Protoporphyrin-Lipids: Their Synthesis, Liposomal Formation and Efficient Delivery to Tumor" S. Tachikawa, M. E. El-Zaria, R. Inomata, S. Sato, H. Nakamura, Bioorg. Med. Chem. ASAP (2014).
2) 「がん光線力学療法のためのDDS薬剤の開発:ポルフィリン脂質の開発とナノキャリアへの応用」 立川将士、中村浩之, 月刊 光アライアンス、印刷中(2014)
3) "A novel photodynamic therapy for drug resistant prostate cancer cells using porphyrus Envelope as a novel photosensitizer" M. Yamauchi, N. Honda, H. Hazama, S. Tachikawa, H. Nakamura, Y. Kaneda, K. Awazu, Photodiag. Photodynam. Ther. 11, 48-54 (2014).
4) "In vitro investigation of efficient Photodynamic Therapy using non-viral vector; Hemagglutinating virus of Japan envelope" N. Fujimoto, M. Sakai, K. Ishii, H. Nakamura, Y. Kaneda, K. Awazu, J. Biomed. Opt. 17, 078002 (Jul 17, 2012).



