最新の研究
- 2014.12.17
ホタルが光る仕組みによって明らかにする「タンパク質の出会い」
〜新原理のタンパク質間相互作用検出系の開発〜
はじめに
ヒトゲノムとそこにコードされるタンパク質の実体がほぼ明らかになり、約10年が経過しました。しかし、生命の神秘は未だ解明されたとは言い難く、様々な病気の原因も不明です。その一因として、タンパク質の機能、特にタンパク質同士の相互作用について、理解が不十分なことがあげられます。現在、ヒト細胞内には、15〜30万種類のタンパク質間相互作用が存在すると言われています。 これらの時間的・空間的な変化やその制御機構の理解は、生命現象の解明に不可欠であるのみならず、疾患治療薬の開発などのために極めて重要です。
このような相互作用検出法の重要性は多くの先達によって認識され,これまで多数の検出系,選択系が考案され、利用されてきています。例えば、特に細胞内での検出に良く用いられるProtein-fragment Complementation Assay (PCA)と呼ばれる方法があります。PCAにおいては、酵素や蛍光タンパク質などのレポータータンパク質を2つに分割してプローブとし、相互作用パートナーにそれぞれ融合させます。相互作用時にこれらプローブが近接し、レポータータンパク質が再構成し活性を回復することを利用して相互作用を検出します。この系は、特に細胞内で高いシグナル/バックグランド(S/B)比で迅速、簡便に相互作用が検出できる特徴がありますが、プローブが不安定で精製タンパクを用いた試験管内での測定が難しい問題がありました。そこで我々は最近、このような問題のない酵素変異体同志の活性相補を原理とする新規タンパク質間相互作用検出系、FlimPIA (Firefly luminescent intermediate Protein-protein Interaction Assay)を開発しました1)2)。
1.ホタル発光酵素の発光反応機構を利用した相互作用検出系FlimPIA
ホタルを始めとする発光生物の放つ幻想的な光には、誰しも魅了されるものです。我々は以前よりその発光酵素ルシフェラーゼ (Fluc)の発光色に,さらに反応機構に興味を持ち3),研究を行ってきました。その間,酵素の結晶構造が基質結合状態で4)明らかとなり,これらの問題にも終止符が打たれたかに思われました。しかし,実際にはまだ謎が残っており,例えば最近、Flucはその構造を変化させながら2段階の酵素反応を行うことが報告されています5)6)。Flucは、全長約550アミノ酸からなるN末ドメインとC末ドメインが柔軟なヒンジ部位を介して連結した構造を持ちますが、この酵素はあるコンフォメーションで基質ルシフェリン (LH2)とATPからアデニル化ルシフェリン (LH2-AMP)を産生するアデニル化反応を行い、次にC末ドメインが約140°回転し、別のコンフォメーションで酵素中のLH2-AMPに酸素を付加し、発光物質オキシルシフェリン (OxL)を産生する,というのです(図1A)。
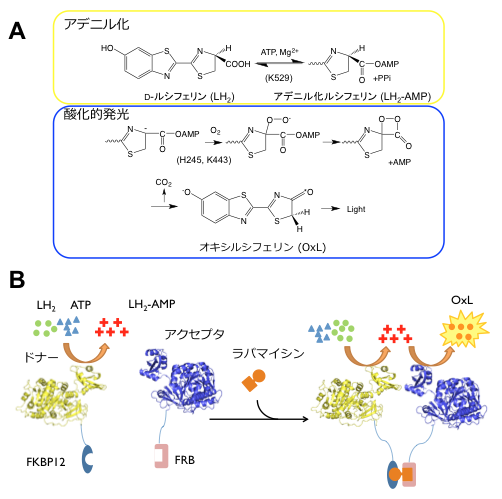
図1 ホタルルシフェラーゼの発光反応とFLimPIAの原理
(A) ルシフェラーゼの触媒する化学反応。大きくアデニル化と酸化的発光反応に分けることが出来る。カッコ内は触媒残基
(B) FlimPIAの原理。酸化的発光反応が遅いFluc変異体(ドナー)とアデニル化反応が遅いFluc変異体(アクセプタ)を用いる。相互作用時にドナーとアクセプタが近接し、反応中間体LH2-AMPのリレーにより発光活性が高まる。
その第一の根拠は、他のファミリー酵素と同様にアデニル化反応・酸化的発光反応のそれぞれの半反応において重要な触媒残基が異なる点です。すなわちアデニル化に重要なC末ドメイン残基はK529である一方、酸化的発光反応に重要な残基はK443であり、これは反応に伴うドメインの回転を強く示唆しています7)。また我々は、独自にN末ドメインの活性残基H245をAspに変異させると酸化的発光反応のみが抑えられることを見いだしていました3)。
我々はここで、もし1つの半反応のみが効率よく行われ、別の半反応が行われないような変異体同士を組み合わせれば、反応中間体であるLH2-AMPの受け渡しを原理としたタンパク質間相互作用検出系が構築できるのではないか、と考えました。つまり、それらの変異体と解析対象のタンパク質をそれぞれ融合させて発現させると、タンパク質間相互作用時に変異体同士が十分に近づいて反応中間体の受け渡しを行い、発光反応速度が高まるのではと期待したわけです(図1B)。
そのために、相互作用検出によく用いられる蛍光共鳴エネルギー移動(FRET)になぞらえ反応中間体の"ドナー"として、酸化的発光反応が遅い変異を組み合わせたFluc変異体H245D/K443Aを、また反応中間体の"アクセプタ"として、逆にアデニル化反応が遅い変異体K529Qを作製しました。そして系の検証のため、相互作用タンパク質として、炎症・癌の関連因子、FK506 binding protein-12 (FKBP12)・FKBP12-rapamycin associated protein (FRB)のペアをドナー・アクセプタにそれぞれ融合させプローブとしました。FKBP12とFRBは、免疫抑制剤・抗癌剤である抗生物質ラパマイシンを介して相互作用することが知られています。精製したプローブの活性を試験管内で評価した結果、これらのプローブを単に混合した場合と比べ、さらに各濃度のラパマイシンを加えることで、基質添加後1秒以内に顕著な発光値の上昇がみられました(図2A)。また、動物細胞にベクターを導入してプローブを発現させた場合にも、ラパマイシン依存的な相互作用が検出されました(図2B)。
また、癌に関わるp53-Mdm2相互作用検出系を同様に作製した所、この相互作用を阻害する抗がん剤Nutlin-3を添加することで、発光値の減少が認められました (図2C)。これらの結果は、FlimPIAが相互作用阻害剤スクリーニングにも使える可能性を示唆しています1)。
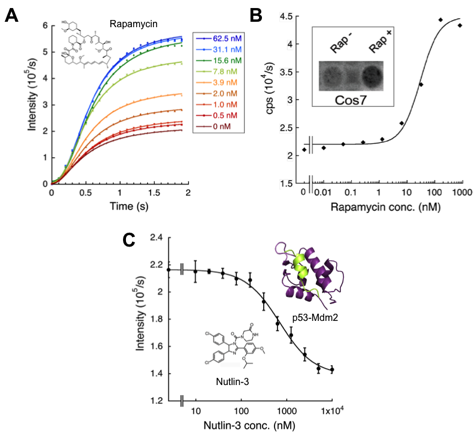
図2 FlimPIAによる相互作用検出
(A) ラパマイシン濃度依存的FKBP12-FRB相互作用の検出。 (プローブ: 50 nM)
(B) グラフ: 293T細胞内での相互作用検出。
枠内: Cos7細胞の発光イメージ。(LAS-4000mini使用)
(C) Nutlin-3によるp53-Mdm2相互作用の阻害。(プローブ: 50 nM)
2.FlimPIAの特長
では従来法と比べたFlimPIAの利点は何でしょうか?まず比較のためPCAの試験管内検出を試みてみました。結果、信号強度安定性ともにFlimPIAよりも低いことが判明しました2)8)。
次に、細胞内外の相互作用検出においてよく用いられる検出系である蛍光タンパク(FP)間の蛍光共鳴エネルギー移動(FRET)との比較を試みました。相互作用検出において、どのぐらい大きなタンパク質同志でも検出できるかは、系の汎用性に関わる重要な性能です。これは、どの程度離れたプローブ間でも信号が検出できるか、と言い換えることも出来ます。FRETにおける検出可能距離はFörster距離R0に依存し、検出シグナルは、プローブ間距離の6乗に反比例して減少するため比較的短いことが知られています。そこで、FRETとの検出可能距離の比較を行いました。従来、水色と黄色のFPであるCFP-YFP間に、長さ7 nmの堅い構造を持つFibronectin Type III domain 7-8 (Fn7-8)を挿入すると、FRET信号が検出不能になることが報告されています9)。そこで我々は、FKBP12-FRB相互作用検出系において、FRET, PCA, FlimPIAのそれぞれにおける片側のプローブとFKBP12の間に、リンカーとしてFn7-8を挿入しました。その結果、FRET,PCAでは検出がほぼ不可能であったのに対し、FlimPIAでは検出可能なことが判明しました。これは、本法ではプローブが空間的に7 nm以上離れていても検出が可能なことを示しています(図3)2)。
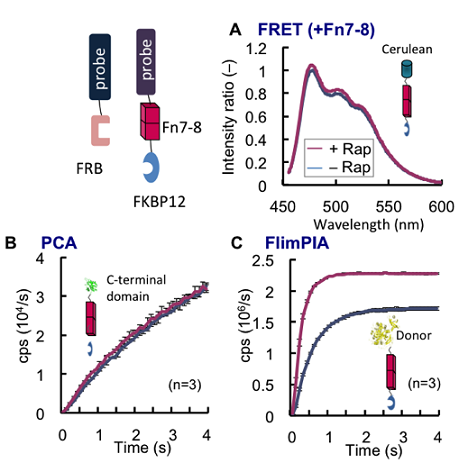
図3 検出可能なプローブ間距離の比較
長さ7 nmの堅い構造を持つリンカーFn7-8をFKBP12とプローブ間に挿入した。その結果、FRET (A)およびPCA (B)ではFKBP12-FRBの相互作用を検出できなかったが、同条件でFlimPIA (C)では検出が可能であった。
3. FlimPIAの応答性改良
開発当初のFlimPIAには、非相互作用時のアクセプタ酵素のバックグラウンド発光のため、相互作用時の信号増大(S/B比)が低いという問題がありました。前述のように、Flucはその構造を変化させながら2つの半反応を行います。そこで、アクセプタを既報に従い酸化的発光反応構造に固定することで、その残存アデニル化活性を低減できないか試みました。
このため、アクセプタのN末とC末ドメイン内の酸化的発光反応構造で近接する一対の残基をそれぞれシステインCysに置換し、これらをチオール特異的クロスリンカーである1,2-bis(maleimide)ethane (BMOE)、あるいはより簡便にジスルフィド架橋し、酸化的発光反応構造に固定しました。その結果、完全な架橋には至りませんでしたが、顕著なS/B比の向上に成功しました2)。また最近、別の点変異導入と反応条件改良による更なる応答の向上にも成功し、今後はより多くの相互作用検出に使えるものと期待されます(投稿中)。
4.おわりに
1つの酵素を、物理的にではなく化学反応的に分割した相互作用検出系をご紹介しました。特に抗体など、大きなタンパク質間の相互作用を試験管内で測定するのに適した方法として、今後簡便高感度な臨床診断などへの応用が期待されます。さらに同様のアプローチは他のファミリー酵素でも可能と思われ、合成生物学等における新たな酵素活性制御法としての利用も期待されます。
参考文献
1) Ohmuro-Matsuyama Y et al., Anal. Chem., 85, 7935-7940 (2013)
2) Ohmuro-Matsuyama Y et al., ibid., 86, 2013-2018 (2014)
3) Ayabe K et al., FEBS Lett., 579, 4389-4394 (2006)
4) Nakatsu, T., et al., Nature, 440, 372-376 (2006)
5) Branchini BR et al., J. Am. Chem. Soc., 133, 11088-11091 (2011)
6) Branchini BR et al., Biochemistry, 51, 6493-6495 (2012)
7) Branchini BR et al., ibid., 44, 1385-1393 (2005)
8) Ohmuro-Matsuyama Y et al., BMC Biotechnol. 13,31 (2013)
9) Ohashi T et al., Protein Sci., 16, 1429-1438 (2007)



