最新の研究
- 2015.12.01
- 中村・岡田研究室
ヘムを触媒とするチロシン残基選択的な化学修飾法開発
機能性タンパク質の化学修飾は、検出タグ導入、固相担持といった生物学研究における有用なツールとなるだけでなく、抗体修飾による代謝安定化、殺細胞性などの機能付与は、近年急激な成長を遂げているバイオ医薬においても重要な研究課題である。
天然のタンパク質は20種類のアミノ酸の組み合わせからなり、特定のタンパク質(抗体や酵素)に機能を付与するには、タンパク質を構成する特定のアミノ酸残基上での共有結合形成が必要不可欠である。しかし、従来の精製タンパク質の修飾技術はリシン残基、システイン残基といった求核性のアミノ酸残基に対して求電子性の反応剤で修飾する方法がほとんどであり、利用可能な手法論のバリエーションに乏しい。また、抗体医薬開発の分野においてはリシン残基修飾の問題点もいくつか指摘されているが、それに代わる手法論の開発が遅れているのが現状である。
従来の2電子的な反応剤を用いる手法とは別のアプローチとして、1電子的・ラジカル的な反応剤を用いる手法によるチロシン残基、トリプトファン残基等の芳香族アミノ酸残基の分子修飾法開発が近年盛んに研究されている1。そのような研究背景の中で、今回我々はタンパク質やペプチドのチロシン残基と特異的に共有結合を形成するbioorthogonalな反応を見出した(図1)2,3。
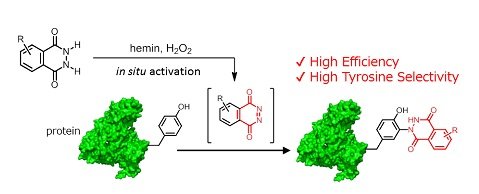 図1.今回我々が見出したチロシン選択的なタンパク質修飾法
図1.今回我々が見出したチロシン選択的なタンパク質修飾法
チロシン残基はタンパク質表面にも露出するアミノ酸残基であり、タンパク質に任意の機能を付与させる足場として適切な標的アミノ酸残基である。これまでにいくつかのチロシン残基修飾法が報告されたが、精製タンパク質のチロシン残基に特異的かつ高い変換効率で共有結合を形成させることは未だ挑戦的な課題であり、信頼性の高いチロシン残基修飾法の開発が切望されていた。
今回我々は、血液痕の判定法で用いられるルミノール反応の反応中間体が環状のdiazodicarbonyl(CO-N=N-CO)構造を持つことと、同様の構造を持つ分子がチロシン修飾法に用いられていること4に着目して、種々のルミノール誘導体とチロシン残基との反応性を鉄ポルフィリン錯体heminと過酸化水素の存在下において評価した。その結果、ルミノール誘導体は従来法よりも高いチロシン残基選択性と高い変換効率を示すことを見出した。
構造最適化の結果、N-methyl体が高いチロシン残基選択性と高い変換効率を示すことが明らかとなった。N-methyl体は発光反応を示さない代わりに、他のクリック反応と比較しても、速い反応速度で(8.55 M-1s-1)、チロシン残基のみを特異的に修飾することが可能であった。
また、モデル基質タンパク質としてBSAを本手法によってラベル化したところ、チロシン残基のみをラベル化することに成功し、タンパク質表面に露出したチロシン残基は、タンパク質内部に局在するチロシン残基よりも効率的にラベル化できることを見出した。
さらに、抗チューブリン抗体をモデルに用いて、本手法を抗体修飾に応用した(図2)。アジドを含む化合物で抗体表面のチロシン残基を修飾し、DBCOを用いたクリック反応によって蛍光団を抗体に導入した。本手法は過酸化水素を用いた酸化的な反応条件を必要とするが、抗チューブリン抗体の抗原認識能を保ったまま検出機能を付与できた。チロシン残基選択的かつ高効率なタンパク質修飾を可能にする本手法はバイオ医薬、高機能性タンパク質素材開発のさらなる加速に資することが期待される。
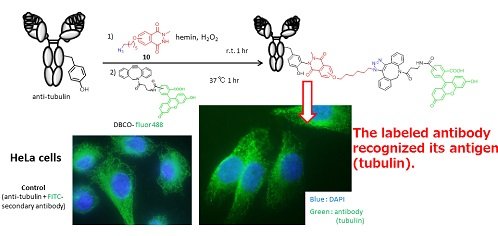
図2. 抗チューブリン抗体の蛍光修飾
本手法によるペプチド/タンパク質の化学修飾において、上記のルミノール誘導体は天然の20種類のアミノ酸の中でもチロシン残基のみと反応し、さらにリン酸化チロシン残基には全く反応しないことがわかっている。一方で、チロシン残基のリン酸化・脱リン酸化は生体内でチロシンキナーゼ・チロシンホスファターゼによって制御されており、がん、糖尿病、アルツハイマー等の疾患への関与が示唆されている。我々は上記の脱リン酸化状態のチロシン残基に高い特異性と高い修飾効率を持つ手法を利用して、現在チロシンキナーゼ・チロシンホスファターゼの高感度な活性測定法の開発研究へと展開している。
参考文献
1 McKay, C. S.; Finn, M. G. Chem. Biol. 2014, 21, 1075-1101.
2 Sato, S.; Nakamura, K.; Nakamura, H. ACS Chem. Biol. 2015, in press.
3 Shudofsky, A. D. Chem. Res. Toxicol. 2015, 28, 2086-2087. (本成果のスポットライト記事)
4 Ban, H.; Gavrilyuk, J.; Barbas, C. F. J. Am. Chem. Soc. 2010, 132, 1523-1525.



