最新の研究
- 2015.12.28
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
生体内のレドックス変化を可視化する
レドックス(redox) とは、還元(reduction)と酸化(oxidation)を合わせた造語で、文字通り酸化還元の意味である。 生体内では、還元物質であるNADHやNADPHの酸化還元の伴う様々な酵素反応が行われて、いわゆる代謝反応全体を駆動しているので、生体内の酸化還元状態は生命を維持する極めて重要なファクターと言うことになる。また、私たちの体内のエネルギー生産装置であるミトコンドリアの呼吸鎖や、植物の光エネルギー変換装置である葉緑体の光合成電子伝達系では、常に還元力を生み出しているので、好気的代謝の副産物として、スーパーオキシドやヒドロキシラジカル、一重項酸素、過酸化水素など非常に強い酸化力を持つ活性酸素種(ROS : reactive oxygen species)が生じることで、日常的に酸化ストレスに曝されることになる。これらのROSは、生体内のタンパク質、脂質など重要な生体構成成分を酸化してしまうため、生体内にはこれらの酸化ストレスに対する防御システムも発達しているが、このシステムもまた酸化還元反応によって成り立っている。
一方、生体内で働いている酵素の中には、酵素分子自身が酸化や還元をされることによってその酵素活性を変化させる、すなわち、生体内環境の変化に応じて活性が調節されている例が数多くある。例えば、光合成反応では、光が当たっているときにだけ二酸化炭素から糖が合成される反応(炭素同化反応)が行われているが、この反応に関わるいくつかの酵素は還元されると酵素活性がオンになるスイッチを備えていて、昼と夜の反応の制御を行っている(図1)。
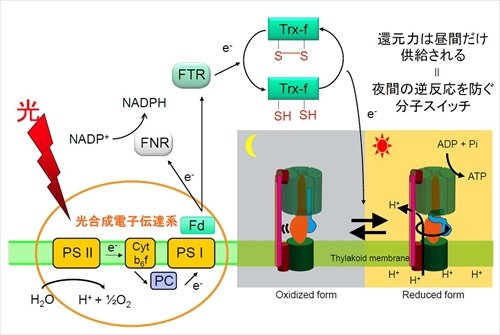 図1.光合成生物の酵素は酸化還元調節されている
図1.光合成生物の酵素は酸化還元調節されている
このように、生体内の諸反応は酸化還元と密接な関係にあるため、生体内の酸化還元状態を知ることは、生体内の代謝系の動きを知るために重要な情報である。この酸化還元状態を知る手段として、生体内のモニターとしてよく使われている緑色蛍光タンパク質(GFP)に2カ所のシステイン置換を行って酸化還元応答性を付与したroGFPという変異タンパク質が開発された(Hanson et al. 2004,文献1)。roGFPは、酸化状態と還元状態で蛍光の励起スペクトルの形状が変化するという分光特性を持っている。また、GFPの誘導体である黄色蛍光タンパク質(YFP)を改変して、過酸化水素に応答するrxYFPも作成されている。
しかし、生体内のレドックス変化は、様々な細胞内オルガネラで同時に起こるため、これらを包括的に研究するためには、複数の異なる色特性を持った蛍光タンパク質が必要である。そこで、私たちは大阪大学産業科学研究所の永井健治教授が開発したGFPの誘導体である新規蛍光タンパク質Siriusをベースとして、新しい酸化還元応答タンパク質を開発することにした。
SiriusにroGFPと同じシステイン変異を導入しただけでは、酸化還元応答性は見られなかった。そこで、発色団周辺のアミノ酸残基の位置を結晶構造に基づいて検証し直し、最終的に導入された二つのシステインの酸化還元(具体的には、ジスルフィド結合の形成と解離)によって蛍光に大きな変化が現れる変異タンパク質を作成することに成功した(文献2)。このタンパク質は、酸化状態において蛍光が顕著に消光(Quench)するため、Oxidation BAlance sensed Quenching Proteinということで、Oba-Qと命名した。その後、青緑色蛍光タンパク質CFPでも同様の変異導入によって、酸化に対して蛍光が消光するタンパク質が得られたため、Sirius由来のものをOba-QS、CFP由来のものをOba-QCと呼ぶことにした。
これらのタンパク質を例えばHeLa細胞の細胞質に導入して外液の酸化還元状態を変化させると、細胞内に発現したこれらのタンパク質の蛍光は素速く応答することがわかった。また、タンパク質の蛍光応答性の中間酸化還元電位を調節することで、細胞内の酸化還元状態のモニターとしても十分に機能できることがわかった(図2)。
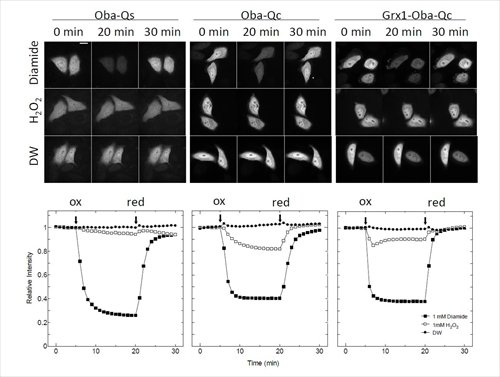
図2. HeLa細胞に発現したOba-Qs, Oba-Qcのレドックス応答
(Sugiura K. et al. BBRC 2015, 457, 242-248より引用)
今後は、これらのタンパク質を様々な生物の様々な細胞内に発現させて蛍光を観察することで、細胞内レドックス変化と代謝過程の変化の対応づけに活用していきたい。
本研究は、5大学附置研究所アライアンス事業に参加している大阪大学産業科学研究所永井健治教授、北海道大学電子科学研究所・太田信広教授・中林孝和准教授との共同研究として実施した。
参考文献
1. Investigating mitochondrial redox potential with redox-sensitive green fluorescent protein indicators.
Hanson GT, Aggeler R, Oglesbee D, Cannon M, Capaldi RA, Tsien RY, Remington SJ.
J. Biol. Chem. (2004) 279(13):13044-13053.
2. Redox sensor proteins for highly sensitive direct imaging of intracellular redox state.
Sugiura K, Nagai T, Nakano M, Ichinose H, Nakabayashi T, Ohta N, Hisabori T.
Biochem. Biophys. Res. Commun. (2015) 457(3):242-248. doi: 10.1016/j.bbrc.2014.12.095.



