最新の研究
- 2016.06.22
- 北口研究室
任意物質による酵素活性制御を目指して
〜抗体融合アロステリック酵素の開発〜
上田・関研究室
はじめに
天然酵素の中には,基質やそれ以外の分子(リガンド)によってその活性が制御されるものがしばしば見られ,これらはアロステリック酵素と呼ばれます。多量体酵素の各サブユニットが,リガンド結合によって協同的にその構造を微妙に変化させることで実現される場合が多く,これを人工的に構築する事は至難の業と言われてきました。しかし近年,Ostermeierらは分子進化工学的手法を駆使して,ある種の糖結合タンパク質(麦芽糖結合タンパク質Maltose Binding Protein)と抗生物質耐性酵素であり活性測定が容易なβラクタマーゼをうまく結合させる事で,麦芽糖の結合によりβラクタマーゼ活性が顕著に変化する融合タンパク質が創製できた,と報告しました1,2)。二つの由来の異なる単量体タンパク質を融合することで,アロステリック酵素と同様の性質を示す酵素が創出されたという意味で,これらの仕事は画期的です。しかし,このタンパク質は麦芽糖か,改造してもせいぜい構造類似のブドウ糖にしか応答せず,方法の汎用性という意味では物足りなさも感じられました。そこで我々は今回これを発展させ,潜在的にあらゆる分子を認識可能な,抗体タンパク質の一部を融合することで,汎用性のあるアロステリック酵素が構築できないか試みました。
1. 抗体可変領域と円順列変異βラクタマーゼとの融合タンパク質3)
我々はまず,抗体の抗原結合部位である可変領域Fvと,既報で用いられた円順列変異(注1)導入βラクタマーゼを結合させた融合タンパク質Fv-cpBLAを作製しました(図1)。
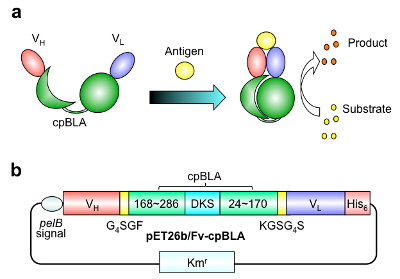
図1 第Ⅰ世代酵素Fv-cpBLAの構造(a)模式図と(b)遺伝子構造(©American Chemical Society)
材料となる抗体としては,低分子抗原である,骨疾患の診断にも用いられるオステオカルシン(BGP)のC末端ペプチド認識抗体,および近年その環境中への悪影響が懸念されるネオニコチノイド系農薬イミダクロプリド(ICP)認識抗体の2種類を用いました。これら低分子認識抗体のFvは,抗原結合により安定化,すなわちFvを構成する二つの断片VHとVL間の相互作用が強まる事が,我々の過去の研究から明らかとなっています。すなわち,Fv-cpBLAは,抗原結合によりFvが安定化し,その安定化がcpBLAの安定化と活性化につながることを期待したのです。
これら2種類のFv-cpBLAを大腸菌を用いて発現・精製し,ペプチド抗原BGP-C7を加えた所,有意なβラクタマーゼ活性の上昇が認められました(図2a)。これに対し,この抗体に結合しないICP, TCPを加えても活性化は起こらず(図2b),念のためFvを持たない野生型酵素BLAに対しBGP-C7を加えても酵素活性は変化しませんでした(図2c)。
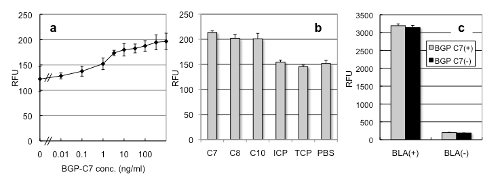
図2 BGP認識Fv-cpBLAの抗原依存的酵素活性
(a) 蛍光基質Fluorocillinを用いた酵素活性測定の結果。BGP-C7は抗原であるC末7残基ペプチド
(b) 活性変化の特異性。C8, C10は長さの違うBGPのC末ペプチド。
(c) 野生型BLAの活性に対するBGP-C7の影響
さらにICP認識抗体を用いたFv-cpBLAに関しても,抗原ICPへの結合能(図3a),ICPおよび構造類似の農薬TCP添加による酵素活性の上昇(図3b,c)が見られました。特筆すべき事に,Fv-cpBLA発現菌を抗生物質アンピシリンを加えた培地で培養した所,抗原を添加した場合に増殖が促進される,すなわちあたかも農薬で増える大腸菌ができた,という画期的な結果を得ました(図3d)。その機構としては,ICPあるいはTCP依存的に向上したFv-cpBLAのβラクタマーゼ活性により,アンピシリンが分解され菌の増殖につながったものと考えられます。
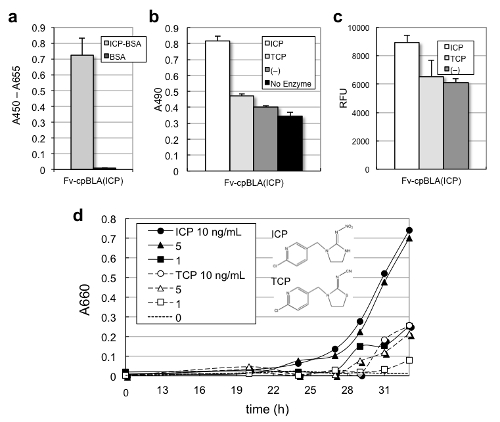
図3 ネオニコチノイド農薬認識Fv-cpBLAの抗原依存的酵素活性(©American Chemical Society)
(a) 抗原結合能の確認。抗原ICPを結合させたBSAへの結合をELISA法で検出した。
(b) 発色基質Nitrocefinを用いた活性測定。抗原特異的な活性上昇が見られた。
(c) Fluorocillinを用いた活性測定。
(d) 抗原依存的な細胞増殖。アンピシリン含有培地へのICPあるいはTCP添加により,Fv-cpBLA発現菌の有意な増殖促進が見られた。
以上の結果は,原理の証明(Proof of principle)としては十分なものと言えます。しかしバイオセンサーとしての感度は通常の免疫測定とほぼ同等であるものの,酵素活性応答は最大で2倍に満たなかったことから,実用的な検出系としてはやや物足らない可能性も考えられました。
2. 円順列変異導入VH/VL (Clampbody)の創製
そこで,より高い抗原応答を実現するため,次に我々はOstermeierらと同様,リガンド結合部位である抗体部分にも円順列変異を導入することを試みました。このため,Fvを構成する二つの断片VH, VLそれぞれの元来のN-C末端を柔軟なリンカー(Gly4Ser)3で結合させ,新たなN/C末端をVH/VL界面に近い,抗原結合部位から離れたループ部位とした断片cpVH, cpVLを設計しました。そしてこれら二つの複合体を,Fvに代わる抗原結合部位としてClampbody (Cbody)と名付けました。
まずClampbody自身が抗原結合能を維持しているか確かめるため,cpVHとcpVLを短いリンカーで結合させた一本鎖Clampbody (sc-Cbody) (図4a)を作製しました。次にcpVH, cpVLの末端に,前項同様円順列変異導入βラクタマーゼを結合させたCbody-cpBLA(図4b)を構築しました。ただし,cpBLAとしては,より精密な分子設計のため,最近その結晶構造が解明されたものを用いました4)。そしてこれらを大腸菌不溶性画分で発現させ,可溶化,金属アフィニティカラムで精製した後,抗体活性を復活させるため酸化還元状態をコントロールしながらリフォールディングして以下の解析に用いました。
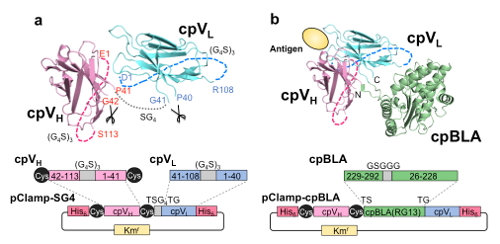
図4 BGP認識一本鎖Clampbody (sc-Cbody) (a)と,第二世代酵素Cbody-cpBLA (b)の模式図。ClampbodyのVH部分cpVHの末端には,ドメイン安定化のためSS結合用のCys残基ペアを導入した。(©American Chemical Society)
3. Clampbody融合酵素の抗原による活性化5)
次にこうして作製したClampbodyが抗原結合活性を保持しているかを,ELISA法により確認しました(図5)。この結果,sc-Cbody (a)およびCbody-cpBLA (b)のいずれにおいても抗原BGPペプチドに対する結合能が保持されている事が確認されました。
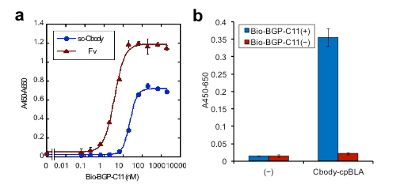 図5 抗原結合能の確認。(a)一本鎖Clampbodyは野生型Fv (VHとVLの混合物)よりやや低いが,固定化抗原(ビオチン化BGPペプチド)濃度依存的な結合能を有していた。(b)融合蛋白質の抗原結合能。いずれもストレプトアビジン固定化プレートとペルオキシダーゼ標識抗Hisタグ抗体にて検出した。(©American Chemical Society)
図5 抗原結合能の確認。(a)一本鎖Clampbodyは野生型Fv (VHとVLの混合物)よりやや低いが,固定化抗原(ビオチン化BGPペプチド)濃度依存的な結合能を有していた。(b)融合蛋白質の抗原結合能。いずれもストレプトアビジン固定化プレートとペルオキシダーゼ標識抗Hisタグ抗体にて検出した。(©American Chemical Society)
次に,構築したCbody-cpBLAの酵素活性を蛍光基質を用いて評価しました(図6)。最初にリン酸緩衝液中で測定した場合には,1 µMの抗原の有無で期待したほどの活性変化は見られませんでした(a)。しかし,活性の絶対値はFv-cpBLAに比べて遙かに高く,かつわずかながら抗原による活性化も見られました。そこで"Cbody-cpBLAは抗原不在時でも安定な構造を取っている"と考え,次に抗原不在時の活性を低下させるため,緩衝液に薄い変性剤(b),あるいは界面活性剤(c)を加えてその効果をみました。その結果,いずれの場合にも活性の絶対値は下がりましたが,抗原による活性上昇効果は顕著に高まりました。そこで(c)の条件で,酵素活性(蛍光増加率)の抗原濃度依存性をプロットした所,最大4.7倍の抗原による活性化が観察され,健常人の血中濃度を下回る1 nM以下の抗原が検出可能,という結果を得ました。すなわち,本手法により,抗原による効果的な酵素活性制御に成功しました。
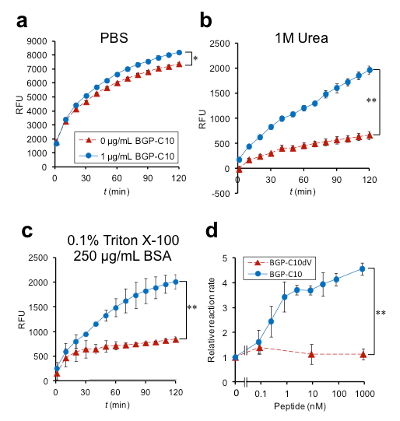
図6 抗原によるC-body-cpBLAの酵素活性変化。(a)-(c)は上に記した緩衝液条件での蛍光強度の時間変化を示す。(d)は(c)条件での活性の抗原濃度依存性を示す。(©American Chemical Society)
4. おわりに
最近,アロステリック制御のモデルとして,従来のコンフォメーション変化に基づく制御に加え,リガンドによる安定性制御(ensemble model)もある,という報告がなされました6)。今回得られた結果はまさに後者に属するものと考えられます。また変性剤のみならず,界面活性剤でも活性が制御されたことから,疎水性相互作用が酵素の安定性に重要な役割を果たしていると考えられます。今後,酵素の内部疎水性残基等への変異導入により,より温和な条件での活性制御が可能になり,より実用的な「抗原センサー」となることが期待されます。
参考文献
1) Guntas, G., Mansell, T. J., Kim, J. R., et al.: Proc. Natl. Acad. Sci. USA, 102, 11224-11229 (2005)
2) Ostermeier, M.: Protein Eng Des Sel. , 18, 359-364 (2005)
3) Kojima, M., Iwai, H., Dong, J., et al.: Bioconj. Chem., 22, 633-641 (2011)
4) Ke, W., Laurent, A. H., Armstrong, M. D., et al.: Plos One, 7, e39168 (2012)
5) Iwai, H., Kojima-Misaizu, M., Dong, J., et al.: Bioconj. Chem., 27, 868-873 (2016)
6) Choi, J. H., Laurent, A. H., Hilser, V. J., et al.: Nat Commun, 6, 6968 (2015)
注1)あるタンパク質の元来の二つの末端を結合させ,他の部分に新しい末端を移すタンパク質への変異導入法。天然タンパク質においても遺伝子重複等の結果でしばしば見られる。



