最新の研究
- 2017.04.03
- 中村・岡田研究室
Horseradish Peroxidaseを利用したタンパク質チロシン残基のラベル化法の開発
機能性タンパク質の化学修飾は、検出タグ導入、固相担持といった生物学研究における有用なツールとなるだけでなく、抗体修飾による代謝安定化、殺細胞性などの機能付与は、近年急激な成長を遂げているバイオ医薬においても重要な研究課題である。
天然のタンパク質は20種類のアミノ酸の組み合わせからなり、特定のタンパク質(抗体や酵素)に機能を付与するには、タンパク質を構成する特定のアミノ酸残基上での共有結合形成が必要不可欠である。しかし、従来の精製タンパク質の修飾技術はリシン残基、システイン残基といった求核性のアミノ酸残基に対して求電子性の反応剤で修飾する方法がほとんどであり、利用可能な手法論のバリエーションに乏しい。
従来の2電子的な反応剤を用いる手法とは別のアプローチとして、1電子的・ラジカル的な反応剤を用いたチロシン残基、トリプトファン残基等の芳香族アミノ酸残基の分子修飾法開発が近年盛んに研究されている。チロシン残基修飾法に関しては、いくつかの有用な手法が開発されているが、チロシン残基のラベル化効率、残基選択性の高い手法が望まれている。
一方で、西洋わさびペルオキシダーゼ(Horseradish Peroxidase、HRP)を用いてチロシン残基を修飾することは古くから研究されており、HRPを触媒としたチロシン-チロシンのクロスカップリング反応1-3、やチロシン残基を模倣したチラミドの類縁体(Scheme 1A)によるチロシンの修飾反応が知られている。HRP触媒とチラミドによるチロシン残基修飾は蛍光免疫染色のシグナル増幅法4,5にも応用されている。よってHRPを触媒として利用するチロシン残基修飾法は生物学分野での有用性が期待されているが、修飾剤として用いられているチラミドは修飾効率の面で改善の余地がある6。そこで我々は従来のチラミドに代わる有用な修飾剤の開発を目標に研究に着手し、最近、N-メチルルミノール誘導体がHRP触媒により効率的にチロシン残基と共有結合を形成することを見出した7 (Scheme 1B) 。
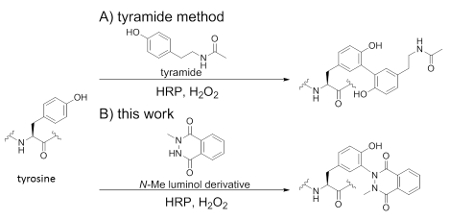
図1.HRPを触媒とするチロシン修飾法。
(A)チラミド法(B)今回我々が見出した方法
HRPと過酸化水素による反応条件において、チロシンの誘導体の修飾反応の効率をLC-MSにより測定した。HRP触媒によるチラミドとチロシン残基の結合効率は低いものであり、望みのチラミド―チロシン残基間の結合形成よりも、チロシン-チロシン間の反応や、チラミドの酸化反応、チラミドのオリゴマー化が副反応として起きていることが分かった(Figure 2 A)。一方、N-メチルルミノール誘導体を修飾剤として用いた場合には、副反応を生じることなく、チロシン残基が効率よくラベル化された(Figure 2 B)。
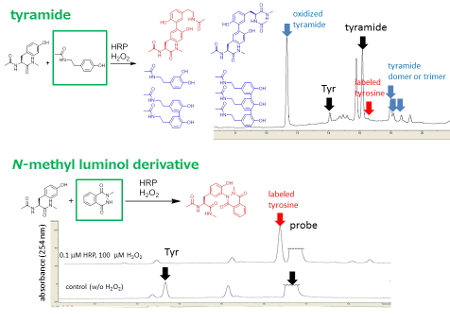
図2.LC-MS分析によるHRP触媒チロシン残基修飾法の効率比較
また、タンパク質のラベル化において、チラミドとN-メチルルミノール誘導体で比較を行った。モデル基質として種々の濃度のウシ血清アルブミン(Bovine Serum Albumin、BSA)を蛍光ラベル化した際の蛍光検出感度を比較した。反応にはCy3ラベル化したチラミド、N-メチルルミノール誘導体を用いた。その結果、N-メチルルミノール誘導体はチラミドを上回るラベル化効率を示すことが分かった。チラミドでラベルされたBSAの蛍光での検出限界は約5 pmolだったのに対して、N-メチルルミノール誘導体は0.5 pmolのタンパク質量でも十分に検出することが可能であった。
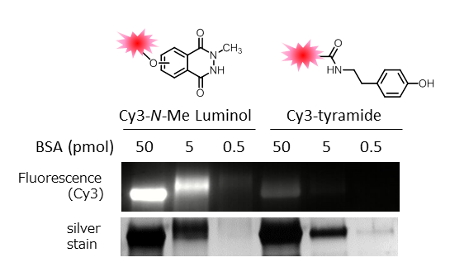
図3.BSAの蛍光修飾における両修飾剤のラベル化効率比較
今回、我々が見出したN-メチルルミノール誘導体がHRP触媒によって効率的なチロシン残基修飾を示すことを明らかにした。冒頭でも述べた様、HRPは生物学の分野で良く使われるタグ酵素であり、HRP共役抗体は生化学実験に汎用される。HRPを用いて効率的なタンパク質修飾を可能にする本手法は、HRP共役抗体の抗原のシグナル増幅への発展や、他のペルオキシダーゼを標的・利用した生化学実験手法への応用が期待できる。
References
1A. J. Gross, I. W. Sizer, J. Biol. Chem. 1959, 234, 1611-1614.
2K. Minamihata, M. Goto, N. Kamiya, Biotech. J. 2015, 10, 222-226.
3K. Minamihata, M. Goto, N. Kamiya, Bioconjug. Chem. 2011, 22, 74-81.
4R. P. van Gijlswijk, H. J. Zijlmans, J. Wiegant, M. N. Bobrow, T. J. Erickson, K. E. Adler, H. J. Tanke, A. K. Raap, J. Histochem. Cytochem. 1997, 45, 375-382.
5L. Yuan, L. Xu, S. Liu, Anal. Chem. 2012, 84, 10737-10744.
6H. W. Rhee, P. Zou, N. D. Udeshi, J. D. Martell, V. K. Mootha, S. A. Carr, A. Y. Ting, Science 2013, 339, 1328-1331.
7S. Sato, K. Nakamura, H. Nakamura, Chembochem 2017, 18, 475-478.



