最新の研究
- 2017.06.16
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
- (旧)久堀・若林研究室
シアノバクテリアのレドックス制御システムの重要性
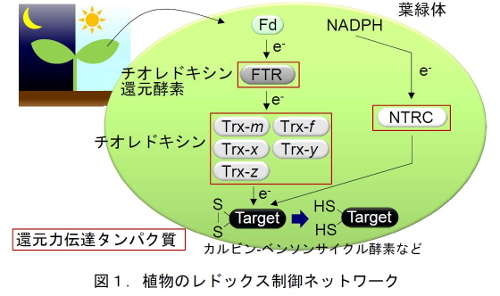
レドックス制御とは、生体内の酸化還元状態に応じてタンパク質の酸化還元状態を調節することにより代謝系を調節する重要な制御機構である。特に、植物の葉緑体では、光化学反応で水の分解によって生じる還元力が、光合成電子伝達系からフェレドキシン、チオレドキシン還元酵素、および、チオレドキシンを介して葉緑体で働いている様々な酵素に伝達され、その生理活性を制御している。さらに,この還元力伝達経路は一本道でなく,光合成反応で生じるNADPHを還元力としてNADPHチオレドキシンレダクターゼC(NTRC)を介して伝達する別経路も存在しており、複雑なレドックスネットワークを形成していることがわかってきた(図1.Yoshida and Hisabori, Proc. Natl. Acad. Sci. USA 2016)。
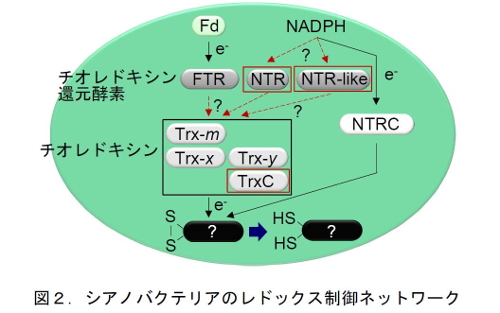
このような光合成生物におけるレドックス制御システムの起源を理解するため、シアノバクテリアのレドックス制御システムの研究を行った。シアノバクテリアは、葉緑体の起源と考えられているが、植物葉緑体とは異なる還元力伝達タンパク質を持っている(図2)。これまで、シアノバクテリアでは、どのようなレドックスネットワークが構成されていて,それがどのように代謝機構を制御しているのかほとんど分かっていなかった。
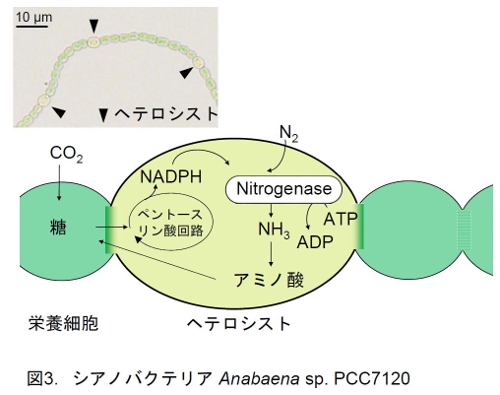
そこで、シアノバクテリアAnabaena sp. PCC 7120(以下、A. 7120と略記する)のレドックスネットワークを調べてみることにした。A. 7120は糸状性のシアノバクテリアで、窒素源が欠乏すると、光合成を行なう栄養細胞10-20細胞に1細胞の割合で、ヘテロシストという特殊な細胞が分化し、大気中の窒素を取り込んで直接、窒素固定を行なうことが出来る、ユニークなシアノバクテリアである(図3)。ヘテロシストでは、窒素固定酵素ニトロゲナーゼによって窒素分子が還元され、アンモニアが生成する。このアンモニアはアミノ酸合成に利用され、生成したアミノ酸は隣接する栄養細胞に供給される。一方、ヘテロシストに隣接する栄養細胞からは糖が供給され、この糖を酸化的ペントースリン酸経路で代謝することにより、窒素固定に必要な還元力を獲得している。
これまでにA. 7120のレドックス制御システムの一部が明らかになっており、ニトロゲナーゼの還元力となるNADPH生産に関与するグルコース6リン酸デヒドロゲナーゼがチオレドキシンm1 (Trx-m1)によるレドックス制御を受けることなどが報告されている。当研究室では、すでにTrx-m1の標的タンパク質の網羅的探索を実施し、窒素固定に関与するタンパク質であるNifU, NifK, NifHなどをチオレドキシンの標的タンパク質候補として同定している。
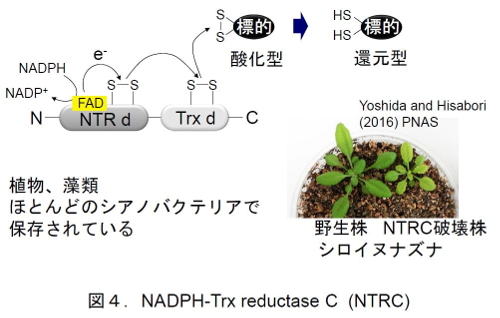
興味深いことに、A.7120は葉緑体と同じくNTRCを持っている(図4)。NTRCは、NTRドメインとTrxドメインからなるハイブリッドタンパク質で、NADPHからの還元力を標的タンパク質に伝達することができる。緑色植物シロイヌナズナでは、NTRCを欠損すると著しい生育阻害が起こることが報告されているが、A. 7120のNTRCがどのような役割を果たしているのかはこれまでわからなかった。
 そこで、まず、NTRCアフィニティークロマトグラフィーによってA. 7120細胞内のNTRC標的タンパク質の捕捉、および、同定を行なったところ、抗酸化システムで作用する2-Cys Prx、1-Cys Prx、硫黄代謝に関与するPAPS レダクターゼ、二酸化炭素固定に関与するホスホグリセリン酸キナーゼ、トリオースリン酸イソメラーゼ、解糖系で作用するエノラーゼなどが標的候補として同定された。このうち、2-Cys Prx、1-Cys Prx、PAPS レダクターゼ、エノラーゼは、先に行なわれたTrx-m1の標的候補としても同定されていた。
そこで、まず、NTRCアフィニティークロマトグラフィーによってA. 7120細胞内のNTRC標的タンパク質の捕捉、および、同定を行なったところ、抗酸化システムで作用する2-Cys Prx、1-Cys Prx、硫黄代謝に関与するPAPS レダクターゼ、二酸化炭素固定に関与するホスホグリセリン酸キナーゼ、トリオースリン酸イソメラーゼ、解糖系で作用するエノラーゼなどが標的候補として同定された。このうち、2-Cys Prx、1-Cys Prx、PAPS レダクターゼ、エノラーゼは、先に行なわれたTrx-m1の標的候補としても同定されていた。
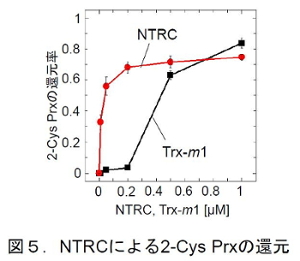
次に、NTRCから2-Cys Prxへの還元力伝達を調べたところ、2-Cys Prxが二量体化して形成する分子間ジスルフィド結合が、NTRCにより特異的に還元されること、さらに、反応速度論的な解析によって、2-Cys Prxの場合は、チオレドキシンよりもNTRCによって効率よく還元されることがわかった(図5)。エノラーゼを除くすべてのNTRC標的タンパク質候補についてNTRCから還元力が伝達されるかを調べたが、実際に還元力が伝達したのは2-Cys Prxのみであった。これらのタンパク質のレドックス制御には、他の還元力伝達タンパク質、あるいは、グルタチオンなどの酸化還元因子によるレドックス制御を受けている可能性が考えられる。
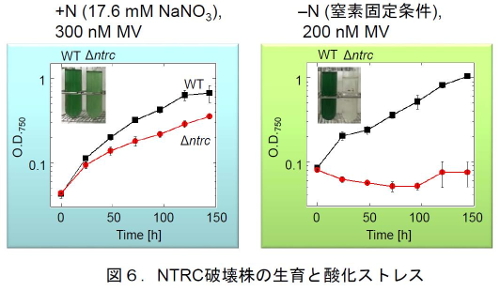
 次に、NTRCの生理的な役割を調べるためにNTRCの遺伝子を破壊したシアノバクテリア(NTRC遺伝子破壊株)を作製した。NTRC破壊株は、A. 7120の染色体DNA上でNTRCをコードしている領域を薬剤耐性遺伝子に置き換えることによって得ることができる。そして、野生株とNTRC破壊株を通常条件で培養し増殖速度を比較した。窒素存在下で培養したもの(+N)と窒素飢餓条件下で培養したもの(-N)を比較したが、いずれの条件下でも野生株とNTRC破壊株の増殖速度に差異は見られず、形態やヘテロシストの形成頻度にも大きな差異は見られなかった。
次に、NTRCの生理的な役割を調べるためにNTRCの遺伝子を破壊したシアノバクテリア(NTRC遺伝子破壊株)を作製した。NTRC破壊株は、A. 7120の染色体DNA上でNTRCをコードしている領域を薬剤耐性遺伝子に置き換えることによって得ることができる。そして、野生株とNTRC破壊株を通常条件で培養し増殖速度を比較した。窒素存在下で培養したもの(+N)と窒素飢餓条件下で培養したもの(-N)を比較したが、いずれの条件下でも野生株とNTRC破壊株の増殖速度に差異は見られず、形態やヘテロシストの形成頻度にも大きな差異は見られなかった。
しかし、メチルビオロゲン(MV)を添加して誘導した酸化ストレス条件下ではNTRC破壊株に顕著な増殖速度の低下が見られ、NTRCが酸化ストレス条件下でのシアノバクテリアの生存に極めて重要な役割を担っていることが明らかになった(図6)。実際、この時の細胞内の2-Cys Prxの酸化還元状態を調べたところ、+N、通常条件下では野生株の2-Cys Prxのほとんどは還元型のモノマーで存在していたが、NTRC破壊株では、約半分が酸化型のダイマーで存在していた。さらに、+N、酸化ストレス条件下では、野生株の2-Cys Prxのほとんどは還元型のモノマーで存在していたのに対し、NTRC破壊株では還元型のモノマーが見られなかった。すなわち、NTRCが欠損すると、2-Cys Prxが十分に還元されず、細胞内にH2O2が蓄積して、様々なタンパク質やDNAにダメージを与えるなど、酸化ストレスの影響が強く出ると考えられる。このように、シアノバクテリアA.7120では、NTRCが抗酸化ストレスシステムにおいて中心的な役割を担っていることが明らかになった。
本研究成果は、現在博士課程2年の見原翔子さんによるもので、Plant and Cell Physiology (2017) 58(1):86-94に論文発表したものである。
参考文献
1. Yoshida K, Hisabori T, "Two distinct redox cascades cooperatively regulate chloroplast functions and sustain plant viability", Proc Natl Acad Sci USA. 2016 Jul 5;113(27):E3967-76. (doi: 10.1073/pnas.1604101113)
2. Mihara S, Yoshida K, Higo A, Hisabori T, ""Functional significance of NADPH-thioredoxin reductase C in the antioxidant defense system of cyanobacterium Anabaena sp. PCC 7120", Plant Cell Physiol. 2017 Jan 1;58(1):86-94. doi: 10.1093/pcp/pcw182.



